O surgimento de patógenos multirresistentes e o lento desenvolvimento de novas drogas potentes se tornaram um problema de saúde pública em todo o mundo. As plantas como novas candidatas a fármacos são muito apropriadas, pois produzem ampla gama de metabólitos secundários com diversas atividades biológicas. Os métodos tradicionais para combater a resistência a drogas estão lentamente se tornando ineficazes, portanto, o direcionamento da detecção microbiana de quorum (QS) ao invés da sobrevivência parece ser uma boa estratégia alternativa, já que a interferência com QS e seu fator de virulência regulado é menos suscetível ao desenvolvimento de resistência. Esta revisão apresenta um banco de dados dos fitocompostos com atividade inibitória do QS contra patógenos bacterianos Gram-positivos e Gram-negativos.
CAPÍTULO 12
Estratégia atual para segmentar
Detecção de Quorum Bacteriano e
Virulência por Phytocompounds
Fohad Mabood Husain 1 , Nasser A. Al-Shabib 1 ,
Saba Noor 2 , Rais Ahmad Khan 3 Mohammad Shavez Khan 4 ,
Firoz Ahmad Ansari 4 , Mohd Shahnawaz Khan 5 , Altaf Khan 6 e
1 Departamento de Ciência e Nutrição Alimentar, Faculdade de Alimentação e Agricultura, Universidade King Saud,
Riade, Reino da Arábia Saudita
2 Centro Rajiv Gandhi de Diabetes e Endocrinologia, Faculdade de Medicina e Hospital Jawaharlal Nehru,
Universidade muçulmana de Aligarh, Aligarh, Uttar Pradesh, Índia
3 Departamento de Química, Faculdade de Ciências, Universidade King Saud, Riad, Reino da Arábia Saudita
4 Departamento de Microbiologia Agrícola, Aligarh Muslim University, Aligarh, Uttar Pradesh, Índia
5 Departamento de Bioquímica, Faculdade de Ciências, Universidade King Saud, Riad, Reino da Arábia Saudita
6 Centro de Pesquisa de Laboratório Central, Faculdade de Farmácia, Universidade King Saud, Riade, Reino de
Arábia Saudita
12.1 INTRODUÇÃO
12.1.1 Quorum Sensing in Bacteria: uma visão geral
A detecção de quorum bacteriano (QS) é uma comunicação célula-célula dependente de densidade.
sistema de comunicação que envolve produção, detecção e resposta a sig-
moléculas conhecidas como autoindutores (AIs). Como a bactéria
aumenta a densidade populacional, os ai acumulam, as bactérias acompanham
informações para monitorar mudanças em seus números de células e alterar o gene
matriz de genes que direcionam o número de atividades benéficas quando realizadas
por grupos de bactérias que atuam em sincronia. QS controla funções importantes
como a bioluminescência, esporulação, competência, produção de antibióticos
secreção do fator de virulência e formação de biofilme ( Ng e Bassler,
em bactérias patogênicas de diferentes origens é controlada por QS
( Tabela 12.1 ). Embora todos os sistemas QS conhecidos sejam diferentes no
componentes e mecanismos moleculares, mas são dependentes de três
princípios: primeiro, secreção de moléculas de sinalização (AIs); segundo, detecção
de AIs pelos receptores existentes no citoplasma ou na membrana;
301
Novo visual para fitomedicina
© 2019 Elsevier Inc.
Todos os direitos reservados.
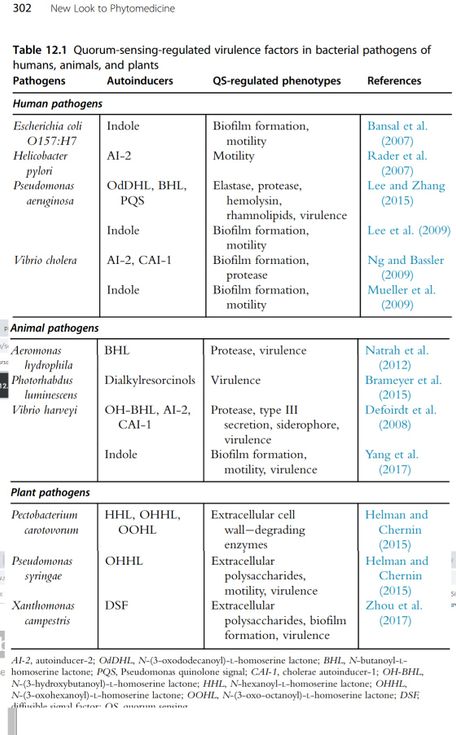
Tabela 12.1 Fatores de virulência regulados pelo sensor de quorum em patógenos bacterianos de
humanos, animais e plantas
Patógenos
Autoindutores
Fenótipos regulados por QS
Referências
Patógenos humanos
Escherichia coli
O157: H7
Indole
Formação de biofilme,
motilidade
Helicobacter
pylori
AI-2
Motilidade
Pseudomonas
aeruginosa
OdDHL, BHL,
PQS
Elastase, protease,
hemolisina,
ramnolipídios, virulência
Indole
Formação de biofilme,
motilidade
Vibrio cholera
AI-2, CAI-1
Formação de biofilme,
protease
Indole
Formação de biofilme,
motilidade
Patógenos animais
Aeromonas
hydrophila
BHL
Protease, virulência
Photorhabdus
luminescens
Virulência dialquilresorcinol
Vibrio harveyi
OH-BHL, AI-2,
CAI-1
Protease tipo III
secreção, sideróforo,
virulência
Indole
Formação de biofilme,
motilidade, virulência
Patógenos vegetais
Pectobacterium
carotovorum
HHL, OHHL,
OOHL
Célula extracelular
parede-degradante
enzimas
Pseudomonas
syringae
OHHL
Extracelular
polissacarídeos,
motilidade, virulência
Xanthomonas
campestris
DSF
Extracelular
polissacarídeos, biofilme
formação, virulência
AI-2, auto-indutor-2; OdDHL, N- (3-oxododecanoil) - L- homoserina lactona; BHL, N-butanoil- L
lactona homoserina; PQS, sinal Pseudomonas quinolona; CAI-1, autoindutor de cólera-1; OH-BHL,
N- (3-hidroxibutanoil) - L- homoserina lactona; HHL, N-hexanoil- L- homoserina lactona; OHHL,
N- (3-oxohexanoil) -L- homoserina lactona; OOHL, N- (3-oxo-octanoil) - L- homoserina lactona; DSF,
fator de sinal difusível; QS, quorum sensing.
302
Novo visual para fitomedicina
e terceiro, ativando a expressão dos genes necessários para o comportamento cooperativo.
Bactérias Gram-positivas e Gram-negativas usam diferentes tipos de QS
sistemas. Bactérias Gram-positivas usam peptídeos, chamados peptídeos auto-indutores
(AIPs), como moléculas sinalizadoras, que são detectadas por
Uma vez produzido nas células, os AIPs são processados e secretados. Quando o
concentração extracelular de AIP atinge um nível limiar, liga-se a
o receptor cognato de quinase de quinase de dois componentes. Esta ligação geralmente
ativa ativamente a atividade quinase do receptor, ele autofosforila e passa
fosfato a um regulador de resposta citoplasmato cognato. O fosforescente
O regulador de resposta ativado ativa a transcrição de genes no regulon QS.
Em alguns casos, os AIPs são transportados de volta ao citoplasma celular onde
interagir com fatores de transcrição para modular a atividade de transcrição
fator e, por sua vez, modula as mudanças de expressão gênica ( Rutherford e
Bassler, 2012 ). Exemplos de comportamentos regulados por QS em bactérias Gram-positivas
Os critérios são competência em Streptococcus pneumoniae e Bacillus subtilis e
produção de fator de ulceração em patógenos, incluindo Staphylococcus aureus,
Listeria monocytogenes, Enterococcus faecalis e Clostridium perfringens ( Autret
As bactérias gram-negativas comunicam-se usando moléculas pequenas como
moléculas (AIs). Estes incluem lactonas de acil-homosserina (AHLs),
2, quinolonas, indole, pironas e dialquilresorcinol ( LaSarre e
Federle, 2013 ). As bactérias gram-negativas utilizam o sistema QS LuxI / LuxR
tems. Neste, o homólogo LuxI é uma sintase IA que catalisa a reação
entre a S-adenosilmetionina (SAM) e uma proteína transportadora de acilo (ACP)
concentrações elevadas, o AHL liga-se a transplantes semelhantes ao LuxR citoplasmático
fator de inscrição. Se a ligação não ocorrer, as proteínas do tipo LuxR
degradar rapidamente, possivelmente para evitar que as bactérias "curto-circuito"
seus sistemas QS. A ligação AHL estabiliza as proteínas do tipo LuxR, permitindo
fazendo-os dobrar, ligar DNA e ativar a transcrição dos genes-alvo
Duced por diferentes bactérias diferem no comprimento da cadeia lateral e cadeia lateral
arranjo. Cadeias acílicas variando de C4 a C18 foram identificadas
303
Estratégia atual para atingir a detecção de quórum bacteriano e virulência por fitocompostos
com modificações como a presença de frações carbonila e hidroxi em
os AHLs promovem a comunicação celular específica de células intraespecíficas em
. As bolsas de ligação de substrato de vários homólogos LuxI têm
correspondentemente formas e tamanhos diferentes, assegurando que apenas um
et al., 2004 ). Da mesma forma, o AI que detecta homólogos de LuxR possui
sítios de ligação que acomodam ligandos de AHL de um tipo particular ( Zhang
12.1.2 Estratégias de Interferência de Sensoriamento de Quorum
QS sendo um comportamento bacteriano de base comunitária e não essencialmente
exigência vival pode ser inibida e interrompida por uma característica desejada como
secreção do fator de virulência, formação de biofilme e resistência a drogas.
Portanto, o desenvolvimento de drogas antipatogênicas ganhou relevância em
o possível tratamento de doenças bacterianas pela atenuação / inibição
inibir QS em bactérias. As vias QS fornecem três pontos principais para o
Ligação inibidor / ligando QS: o gerador de sinal, a molécula sinal,
e o receptor de sinal. Estas três estratégias para inibir QS são
xingado abaixo.
Interferência na geração de sinal: os AHLs são usados como sinalizadores de mole-
nas vias QS pela maioria das bactérias Gram-negativas. A AHL
sintase produz o AHL da cadeia acil correspondente derivada de
os AHL de cadeia curta que são livremente difusíveis, os de cadeia longa
são transportados por bombas de efluxo através da membrana bacteriana ( Pearson
et al., 1999 ). O inibidor QS pode ser projetado para bloquear a atividade de
as bombas de efluxo, biossíntese de ácidos graxos, biossíntese SAM, AHL
vários análogos de SAM, como S-adenosilcisteína, S-adenosil-homocis-
teína e sinefungina, para serem potentes inibidores da síntese de AHL catalisada
pela proteína RhlI de Pseudomonas aeruginosa. S-adenosilcisteína inibida
atividade do P. aeruginosa LuxI homólogo RhlI em até 97% ( Parsek
Degradação das moléculas sinalizadoras: a comunicação bacteriana baseada em QS
pode ser inibida por uma redução na concentração de sinal ativo
molécula no meio ambiente. Degradação completa ou inativação de
304
Novo visual para fitomedicina
as moléculas de sinal de AHL podem ser mediadas quimicamente ou por enzimas
decadência ou metabolismo. Várias enzimas, como AHL-acylase, AHL-
enzimas lactonase e paraoxonase desempenham um papel na degradação de
AHL. Este tipo de ruptura enzimática do QS é tipicamente denominado quo-
quenching rum (QQ). Algumas bactérias para ganhar vantagem seletiva
bloquear as vias QS dos concorrentes por biodegradação enzimática,
enquanto algumas bactérias como P. aeruginosa PAI-A e Variovorax paradoxus
pode usar AHLs como única fonte de energia, carbono e nitrogênio ( Huang
Interferência da recepção do sinal: a inibição da transdução do sinal QS pode
ser executado por uma molécula antagônica capaz de competir ou inter-
com a molécula de sinal AHL para ligação ao
molécula de proteína receptora. Estes podem ser alcançados tanto por
ou inibidores não competitivos. Vários análogos sintéticos foram
projetado por modificações na cadeia lateral de acila ou no anel de lactona ou
em ambas as metades da molécula AHL. As modificações do
furanonas halogenadas naturais também são usadas e provaram ser potenciais
As vias AI-2 e AI-3 também podem ser direcionadas de forma similar
ção de AI-1. Esses sistemas de QS fornecem alvos para projeto e desenvolvimento
de inibidores de amplo espectro. Inibidores que visam o QseC, o
molécula receptora para AI-3 encontrada em numerosos animais importantes e
fitopatógenos têm potencial como drogas de amplo espectro ( Rasko et al.,
12.1.3 Agentes Antiquorum Sensing e Suas Limitações
Os agentes anti-QS foram caracterizados pela primeira vez na alga marinha vermelha, Delisea
pulchra. Esta alga foi investigada por suas propriedades anti-incrustantes e foi
encontrado para conter furanonas halogenadas, compostos que bloqueiam AHLs
via inibição competitiva e desestabilização de LuxR. O estrutural
similaridade permite que as furanonas inibam competitivamente a ação dos sinais de AHL.
de D. pulchra demonstrou ter efeito direto sobre o biofilme
formação é (5Z) -4-bromo-5- (bromometileno) -3-butil-2- (5H) -fura-
inibiu a formação de enxames e biofilmes de Escherichia coli XL1-blue na
superfícies de aço leve com pouca toxicidade para as bactérias. AHL, bem como AI-
Sistemas QS baseados em 2 são inibidos por furanonas, uma vez que estes
305
Estratégia atual para atingir a detecção de quórum bacteriano e virulência por fitocompostos
mimetismo estrutural dos sinais QS (lactonas e anéis de tetrahidrofurano) em
ambos estes sistemas QS ( Ren et al., 2001 ). Embora inicialmente fosse acreditado
que as furanonas inibem competitivamente a ligação de AIs a seus receptores,
agora é evidente que as furanonas halogenadas desestabilizam e aceleram
o volume de negócios da LuxR na Vibrio fischeri e na Vibrio harveyi. Isso prejudica
a capacidade de LuxR para ligar DNA e iniciar a transcrição ( Lowery
O melhor composto de furanona, a furanona 4, pode aumentar a sus-
ceptibilidade do biofilme de P. aeruginosa à tobramicina ( Pan e Ren, 2009 ).
As furanonas bromadas também foram consideradas eficazes contra a
e Ren, 2009 ). Enquanto as furanonas naturais mostraram
Atividade inibitória do quorum sensing (QSI) em algumas espécies, várias
os análogos sintéticos mostraram inibir a formação de biofilme. 1
tal composto chamado furanona 56 ( Fig. 12.1 ) foi demonstrado pela primeira vez
muitos outros furanones ativos, falta uma cadeia lateral e bromo no
anel de furanona. Demonstrou-se que tem pouco efeito sobre o crescimento bacteriano,
síntese de teína e formação inicial de biofilme. No entanto, foi demonstrado
pode penetrar na matriz do biofilme e interferir na maturação do biofilme
uration, presumível por interromper a expressão do gene QS. A eficácia
furanona 56, bem como de uma furanona relacionada, para o tratamento de
infecções pulmonares em modelos de ratos também foi demonstrada ( Wu et al.,
2004 ). Ambos os compostos demonstraram perturbar o AHL QS, enfim
resultando em depuração pulmonar acelerada e tempo de sobrevida prolongado
ratos. Como a maioria dessas furanonas contém halogênios,
impróprios para uso humano. Os furanones investigados são muito reativos e
pode ser muito tóxico para o tratamento de infecções bacterianas em seres humanos ( Hentzer
Natural bromado
furanona
Furanona 56
(sintético)
Ácido penicílico
Patulina
O
O
H
Br
Br
O
O
H
Br
H
O
O
O
O
O
O
OH
Figura 12.1 Inibidores precoces conhecidos de QS de origem algal e fúngica. QS , quórum
de detecção.
306
Novo visual para fitomedicina
Os fungos são conhecidos por produzir metabólitos secundários como antibióticos.
Cerca de 33 Penicillium spp. foram encontrados para produzir QS inibitória
2005 ). No modelo de infecção pulmonar em camundongos, o uso de patulina
reduzir significativamente as infecções causadas por P. aeruginosa, embora
adequado para uso humano devido a problemas de toxicidade.
12.2 DESCOBERTA E EXPLORAÇÃO DO QUORUM-SENSOR
INIBIDORES DE PLANTAS MEDICINAIS
Sabe-se que as plantas medicinais e seus metabólitos secundários são eficazes
contra a infecção causando patógenos mesmo em baixas concentrações
esses metabólitos atuam em vários locais-alvo do patógeno, incluindo a célula
O surgimento de patógenos resistentes a medicamentos levou a pesquisa
comunidade para avaliar a ação de plantas e seus produtos contra QS em
para limitar esta resistência. Várias descobertas informaram que a segmentação
O QS é uma estratégia eficaz para combater infecções causadas por for- mas de biofilme.
concentrando-se nas plantas medicinais e seus fitoconstituintes para procurar
novos fármacos antipatogênicos que poderiam ser explorados como QS não tóxicos
Extratos de várias partes de plantas foram encontrados para inibir QS porque
da similaridade em sua estrutura química com as de moléculas AI
(AHL) e também por causa de sua capacidade de degradar receptores de sinal
propriedades anti-QS estão presentes em toda a planta ou em um dos
partes de plantas como folhas, raiz, sementes, casca e flores. Alguns dos médicos
os inals que possuem propriedade anti-QS são alistados na Tabela 12.2. .
Um total de 24 plantas medicinais indianas foram rastreadas pelo seu anti-QS
propriedade, dos quais extratos de Hemidesmus indicus (raiz), Holarrhena
antidysenterica (casca), Mangifera indica (folhas), Punica granatum (pericarpo),
e Psoralea corylifolia (semente) demonstraram níveis variáveis de in vitro
nas cepas repórter (Chromobacterium violaceum 12472 e C. vio-
laceum CVO26). Redução significativa da motilidade de enxameação
P. aeruginosa PAO1 tratado com estes extratos também foi registrado ( Zahin
et al., 2010 ). A inibição da QS também foi relatada em várias espécies de
307
Estratégia atual para atingir a detecção de quórum bacteriano e virulência por fitocompostos
Tabela 12.2 Atividade anti-quorum de algumas plantas medicinais
Espécies de plantas (família) Produtos
Compostos principais
Cepas testadas
Efeitos com alvo
Referências
Glycyrrhiza glabra
(Fabaceae)
Extrato metanólico
Flavonóides (licoricone,
glicirina, gilzirina)
Acinetobacter baumannii
Diminuição de
formação de biofilmes
e motilidade
Terminalia Chebula
(Combretaceae)
Extrato de frutas
Ácido elágico (benzoico
ácido)
Burkholderia cepacia
Redução do biofilme
Commiphora
leptophloeos
(Burseraceae)
Extrato (casca do caule)
ND
Estafilococo
epidermidis
Inibição de
virulência e
biofilme
Pityrocarpa
moniliformis
(Leguminosae)
Extrair (folhas)
ND
Estafilococo
epidermidis
Inibição de
virulência e
biofilme
Bauhinia acuruana
(Leguminosae)
Extrato (ramos,
frutas)
ND
Estafilococo
epidermidis
Inibição de
virulência e
biofilme.
Terminalia catappa
(Combretaceae)
Extrato metanólico
(folha)
ND
Chromobacterium
violaceum e
Pseudomonas
aeruginosa
Inibição de QS-
violaceína controlada
Produção
Rubus rosaefolius
(Rosaceae)
Extratos fenólicos
ND
Chromobacterium
violaceum
Aeromonas
hydrophila e
Serratia marcescens
Inibição da violaceína
Produção,
motilidade de enxame,
e biofilmes
formação
Centella asiatica
(Apiaceae)
Rica em flavonóides
fração
ND
Pseudomonas aeruginosa
PAO1 e
Chromobacterium
violaceum
ATCC12472
Inibição de
violaceína,
pyocyanin
Produção,
elastolítico e
proteolítico
atividades, pululando
motilidade e
formação de biofilmes
Sclerocarya birrea
(Anacardiaceae)
Extrato metanólico
(casca de caule)
ND
Pseudomonas aeruginosa
Redução de
enxameação, motilidade,
e virulência
produção de fatores
Ocimum sanctum
(Lamiaceae)
Extratos aquosos
ND
Chromobacterium
violaceum e
Pseudomonas
aeruginosa
Inibição violaceína,
pigmento de pyocyanin,
protease, elastase
produção e
formação de biofilme
Ananas comosus
(Bromeliaceae)
Musa paradisiaca
(Musaceae)
Manilkara zapota
(Sapotaceae)
Panax notoginseng
(Araliaceae)
Extrato (flor e
raiz)
ND
Chromobacterium
violaceum e
Pseudomonas
aeruginosa
Interferência com
violacein
produção e
motilidade de enxame,
supressão de LasA
e LasB
Produção
downregulation de
Moléculas de AHLs
Produção
Amomum tsaoko
(Zingiberaceae)
Extrato de etanol
ND
Salmonella
typhimurium, S.
aureus e P.
aeruginosa
Redução do biofilme
formação
Vernonia blumeoides
(Asteraceae)
Hexano
diclorometano,
acetato de etilo e
extratos de metanol
-2- (octadeca-9Z, 12Z-
dieniloxi); -bufa
20,22-dienolide,
catecol; -3,5-
estigmastadien-7-one
Chromobacterium
violaceum e
Agrobacterium
Tumefaciens
Inibição da violaceína
produção e
síntese de sinal
(Contínuo)
Tabela 12.2 (continuação)
Espécies de plantas (família) Produtos
Compostos principais
Cepas testadas
Efeitos com alvo
Referências
Nymphaea tetragona
(Nymphaeaceae)
Extrato aquoso
ND
Chromobacterium
violaceum e
Pseudomonas
aeruginosa
Inibição da violaceína
Produção,
motilidade de enxame,
redução
pyocyanin
produção e
Protease LasA
Cecropia pachystachya
(Cecropiaceae)
Extrato aquoso
Flavonóides C-glicosil
Chromobacterium
violaceum e
Escherichia coli
Inibição de QS
Mangifera indica
Extrato metanólico
ND
Chromobacterium
violaceum, P.
aeruginosa e A.
hydrophila
Violaceína, elastase,
protease, quitinase,
EPS, enxame
motilidade e
inibição de biofilme
Allium cepa
Acetato de etilo
fração (casca)
Quercetina 4
0
-O-β- D
glucopiranósido
Chromobacterium
violaceum, P.
aeruginosa e A.
hydrophila
Violaceína, elastase,
protease, quitinase,
EPS, enxame
motilidade e
inibição de biofilme
Schinus terebinthifolia
Fruta rica em flavonas
extrair
ND
S. aureus
Quench,
inibição da toxina
Produção
Senegalia nigrescens
Extrair
Flavonóides e
terpenóides
C. violaceum
Inibição da violaceína
QS, quorum sensing; AHL, lactona de acil-homoserina; EPS, exopolissacarídeo; ND, não detectado.
Tham, 2011 ). Extratos aquosos de plantas comestíveis e frutas como Ananas
comosus, Musa paradisiaca, Manilkara zapota e Ocimum sanctum
provou ser eficazes QSIs inibindo a produção de violaceína em C. viola-
pigmento ceum e pyocyanin, protease estafilolítica, produção de elastase,
O extrato de hexano do broto de cravo (Syzygium aromaticum) demonstrou signifi-
2012 ). O extrato de frutas de Lagerstroemia speciosa é relatado para atenuar o QS-
genes relacionados (las e rhl) e inibir os fatores de virulência: LasA protease,
Extrato metanólico de Rhizophora annamalayana (casca) apresentou redução
na produção de violaceína e bioluminescência dependentes de QS em C. vio-
2013 ). Frações de etanol de plantas medicinais como Adhatoda vasica, Bauhinia
purpurea, Lantana camara, Myoporum laetum, Piper longum e Taraxacum
officinale mostrou redução significativa no pigmento produzido por C. viola-
Terminalia chebula mostrou atividade inibitória de QS usando Agrobacterium
a estirpe bioreporter tumefaciens, e o extracto reduziu a expressão
Extractos de três plantas medicinais do leste europeu, nomeadamente Quercus robur
córtex (carvalho), brotos da bétula verrucosa (vidoeiro) e Eucalyptus viminalis
Goma) mostrou inibição QS em C. violaceum 31532 e sua derivada
Extrato de metanol padronizado de Sclerocarya birrea (caule) significativamente
rompeu a produção de biofilme mediada por QS e reduziu a mobilidade de
as células PAO1. O extrato mostrou um papel regulador na secreção
protease e piroverdina, dois fatores patogênicos dependentes de QS encontrados
é relatado como inibindo a produção de fatores de virulência regulados pela AHL e
biofilme em P. aeruginosa PAO1 e Aeromonas hydrophila. Aplicação do
extrato resultou em níveis reduzidos de AHL e subseqüente
gene lasb. Estudos in vivo sobre o modelo de nematoide de Caenorhabditis elegans
mostrou maior sobrevida após tratamento com concentração de 1 mg / mL
A atividade da Nymphaea tetragona (extrato metanólico) foi demonstrada
C. violaceum e P. aeruginosa. O extrato em sub-MICs reduziu a violaceína
311
Estratégia atual para atingir a detecção de quórum bacteriano e virulência por fitocompostos
produção significativamente, enquanto em mais de 70% de redução na enxameação
A motilidade da P. aeruginosa também foi registrada. Formação de biofilme em PAO1
foi reduzido consideravelmente eo extrato foi encontrado para ser não tóxico usando
estudo, 12 extratos brutos ricos em tanino de plantas medicinais indianas
avaliado para atividade de inibição de QS. Extratos de Phyllanthus emblica,
Terminalia bellirica, T. chebula, P. granatum, Syzygium cumini e M. indica
(flor) foram encontrados para interferir com o sistema QS de Gram-negativo
(C. violaceum) e bactérias Gram-positivas (S. aureus) de forma eficaz
extrato de schimperiana e éter de petróleo de Justicia schimperiana (semente)
QS extinto na estirpe repórter de E. coli AI1-QQ.1. Cinco frações de M.
indica (folhas) foram selecionados para a sua propriedade anti-QS contra CV12472
estirpe bioreporter. A fração de metanol foi mais ativa contra
O CV12472 e os achados foram confirmados usando a linhagem mutante CVO26. M.
extrato de índio (folhas) demonstrou redução dependente da concentração
funções de virulência de P. aeruginosa e A. hydrophila. Bio-regulado por QS
formação de filme em ambos os patógenos bacterianos foi inibida significativamente.
O potencial antipatogênico in vivo da fração metanólica também foi determi-
minou e reduziu consideravelmente a mortalidade de nemátodes infectados com
extrato de casca (ONPE) inibiu a produção de virulência mediada por QS
fatores como violaceína em C. violaceum e elastase, pyocyanin em P.
ginosa. O ONPE também reduziu a formação de biofilme controlado por QS, exopolysac-
produção de charide (EPS) e motilidade de enxameação em P. aeruginosa e
extrato rico de Schinus terebinthifolia (Brazilian Peppertree), relatou que
o extrato inibiu todos os alelos reguladores do gene acessório de S. aureus (agr)
sem afetar o crescimento do patógeno. Valores de IC 50 variando de
2 a 32 μg / mL foram observados para atividade de extinção de agrotóxicos em transcricional
12.3 PHYTOCOMPOUNDS IDENTIFICADOS COMO QUORUM
INIBIDORES DE SENSAÇÃO
Idealmente, os inibidores da QS devem ser moléculas com baixa massa molecular
redução significativa da expressão de genes regulados por QS e deve ser
específico para o regulador QS específico e ao mesmo tempo não deve ser tóxico
312
Novo visual para fitomedicina
degradado pelo sistema metabólico do hospedeiro ( Kalia, 2013 ). Considerando o
propriedades anti-QS do arranjo de plantas, espera-se que estas plantas
compostos com as propriedades acima mencionadas. Portanto, QS
Os inibidores de fitoconstituintes podem ser classificados nas classes seguintes.
12.3.1 Alcalóides e Derivados
Usando o sistema de teste C. violaceum para triagem da atividade anti-QS, Norizan
et al. (2013) observaram que a cafeína inibiu a produção de violaceína.
Além disso, eles descobriram que a cafeína também era ativa na interferência com a QS em
P. aeruginosa PAO1 suprimindo a produção de moléculas de AHL.
Funções de virulência reguladas por QS de C. violaceum, P. aeruginosa e
alcalóide indol-2-carbinol reduziu a produção de pigmentos no biossensor
estirpe C. violaceum.
A tomatidina, um alcaloide esteroidal, foi avaliada pela sua inibição do QS
atividade contra S. aureus. Este alcalóide foi encontrado para bloquear a expressão
de vários genes que são regulados pelo regulador do gene acessório QS (agr)
sistema, levando à alteração da produção de fatores de virulência como a hemólise
reduziu a produção de α-toxina por S. aureus resistente à meticilina
resultou em diminuição da expressão de RNAIII. Esta observação sugeriu
que a produção reduzida de α-toxina pode ser devida à inibição da
sistema agr.
12.3.2 Compostos e Derivados de Organossulfur
A inibição da violaceína em uma cepa específica de C. violaceum foi observada
isotiocianato de alilo, isotiocianato de benzilo e isotiocianato de 2-fenilo.
Embora estes compostos reduzissem a produção de AHL, estes eram
α-hemolisina por S. aureus. O composto reduz a produção de α-hemolisina
interferência com o sistema agr QS do patógeno.
Iberin, em concentrações sub-inibitórias, inibiu a expressão de
fusão lasB-gfp em P. aeruginosa e mostrou competência com a AHL mole-
culas de moléculas reguladoras. O tratamento com ibina resultou em
313
Estratégia atual para atingir a detecção de quórum bacteriano e virulência por fitocompostos
Outro estudo realizado pelo mesmo grupo mostrou que a interrupção do QS
em P. aeruginosa pelo extrato de alho foi devido a ajoene (um organosulfur
libra). A análise de microarray de DNA revelou que a virulência regulada por QS
Fatores como LasA protease, quitinase e ramnolipídios foram atenuados em
ativação plausível ligando-se a LasR. Erucin também atenuado
QS, mas os efeitos deste composto foram menos pronunciados.
12.3.3 Outros compostos alifáticos e cíclicos
Três análogos de cinamaldeído, nomeadamente, trans-2-nonenal, trans-3-decen-2-
um, e trans-3-nonen-2-one foram relatados para interferir com AI-2 QS;
em Vibrio spp., trans-2-nonenal e trans-3-decen-2-ona inibiram a
Sistema QS baseado em 2, reduzindo a capacidade de ligação de DNA de LuxR,
reduzindo a produção de funções de virulência reguladas por QS, tais como
formação de biofilme, produção de matrizes e produção de protease
atividade inibitória do cis-3-nonen-1-ol em C. violaceum. Eles também testaram
a propriedade anti-QS de vários compostos encontrados no óleo essencial
usando cepas bioreporter de C. violaceum e P. aeruginosa. Dois imitadores de AHL,
estragol e p-anisaldeído, inibiram a produção de violaceína.
12.3.4 Fenólicos
12.3.4.1 Cumarinas
A atividade anti-QS da cumarina foi analisada utilizando três modelos de bioreportadores
estirpes, Serratia marcescens, para as AHL de cadeia curta, C. violaceum, para
AHLs de comprimento médio e A. tumefaciens para AHLs de cadeia longa. Cumarina
demonstrou inibição do AHL de amplo espectro e reduziu a expressão
dos genes pqsA e rhlI. Redução da bioluminescência Aliivibrio fischeri, um
função regulada pelo sistema AI-2 QS, também foi observada após o tratamento
Queda na bioluminescência de duas estirpes de V. harveyi foi registada
tratamento com furocumarinas, diidroxibergamiotina e bergamota
e 7-hidroxicumarina também foram relatados como inibidores da QS-
314
Novo visual para fitomedicina
12.3.4.2 Flavonóides
que a chalcona trans-benzilidenoacetofenona reduziu a expressão de todos os QS
genes excepto lasI. Três outros compostos da mesma classe, 2,3,5-trihy-
droxi-4,6,3-trimetoxicalo- na, 2,3-di-hidroxi-4,6-dimetoxicarilona,
e 2,4,4-tri-hidroxi-3,6-dimetoxicarucona, demonstraram
interferência na sinalização QS de V. harveyi em baixas concentrações.
Investigações sobre as folhas e extrato de casca de Combretum albiflorum
revelou que uma catequina flavanol inibiu violaceína em C. violaceum. este
composto também reduziu a expressão de genes controlados por QS, tais como
lasB, rhlA, lasI, lasR, rhlI e rhlR. O autor sugeriu que catequina
pode inibir QS, afetando a detecção de sinal AHL por RhlT
epicatequina, epigalocatequina e galato de epigalocatequina demonstraram
inibição da violaceína, sinalização reduzida de AI-2 e inibição de AHL,
Flavonóides cítricos naringenina, naringina, neohesperedin, neoeriocitrin,
apigenin, sinensetin, quercetin, kaempferol, and rutin were found to
inhibit either HAI-1 (AHL interspecies signal) or AI-2-regulated biolumi-
nescence in V. harveyi biosensor strain. Naringin, neohesperedin demon-
strated strong inhibition of HAI-1 signaling, while sinensetin reduced
Licochalcone A and E reduced toxin secretion in S. aureus by inhibiting
2012 ). Similarly, luteolin and farrerol caused sixfold reduction in the expres-
sion of agr locus suggesting that α-toxin production in S. aureus is affected
zein in C. violaceum. Rutin, a flavanol reduced the AHL levels in Yersinia
enterocolitica and Erwinia carotovora by inhibiting their synthesis. Brango-
isoorientin, orientin, and rutin from Cecropia pachystachya. Rutin was
found to be active in both E. coli and C. violaceum in QS test system,
while vixetin and orientin were most active against C. violaceum and
E. coli, respectively. Flavonoids licoricone, glycyrin, and glyzarin were
identified for reduction in QS-mediated virulence of Acinetobacter bauman-
nii, and they acted by downregulating the expression of AI synthase, abaI
315
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds
The flavonoids quercetin, quercetin-3-O-arabinoside and quercetin 4
0
-O-
β- D glucopyranoside, have been reported to inhibit QS-regulated viru-
Molecular docking analysis revealed malvidin as the phytoconstituent
responsible for the QS inhibitory activity of S. aromaticum. Docking stud-
ies showed that interaction between LasR receptor protein and malvidin
were hydrophobic. These findings of the in silico study were confirmed
extract rich in proanthocyanidins against P. aeruginosa in Drosophila melano-
gaster model. It decreased the production of AHL-regulated virulence and
protected D. melanogaster from infection. Proanthocyanidin-rich extract
showed reduced production of AHLs, and AHL synthases LasI/RhlI and
QS transcriptional regulators LasR/RhlR genes were inhibited and antag-
onized, respectively.
12.3.4.3 Phenolic Acids
QS inhibition by phenolic acids such as gallic acid and vanillin has been
pigment production but these concentrations were found toxic to mouse
(2009) examined anti-QS activity of vanillin in C. violaceum and A. tume-
faciens. They observed that vanillin inhibited both short-chain and long-
chain AHLs. Another phenolic acid, salicylic acid, has also been reported
for QS inhibition in C. violaceum, E. coli, and P. aeruginosa bioreporter
the Myristica cinnamomea bark extract. Malabaricone C demonstrated anti-
QS activity by reducing the production of violacein pigment in C. violaceum.
Methyl gallate suppressed both the synthesis and activity of AHL in
C. violaceum. It reduced the biofilm formation and other QS-associated
virulence factor of P. aeruginosa. Concentration-dependent decrease in the
expression of lasI/R, rhlI/R, and pqsA of P. aeruginosa was recorded. Em
12.3.4.4 Phenylethanoids and Phenylpropanoids
acid, and ferulic acid on violacein production in C. violaceum bioreporter
316
New Look to Phytomedicine
strain. The compounds inhibited the pigment production, but oleoropein
glucoside and caffeic acid were found toxic during in vivo studies con-
ducted on mouse fibroblast cell lines. Chlorogenic acid is also reported to
acid inhibited violacein production at the highest tested concentration,
and no inhibition of bioluminescence in E. coli. It is very vital to discuss
that the amount of compound used by Brango-Vanegas et al. was lower
than that used in earlier studies.
Cinnamaldehyde was evaluated to assess its potential as a QSI using
C. violaceum, Y. enterocolitica, and E. carotovora. Cinnamaldehyde inhibited vio-
Another study demonstrated that cinnamaldehyde specifically targets short-
chain AHL synthase (RhlI) and inhibits AHL production by RhlI ( Chang
et al., 2014 ). Cinnamaldehyde and its analogs 4-methoxycinnamaldehyde,
2-methoxicinnamaldehyde, and 4-dimethylaminocinnamaldehyde inhibited
AI-2-based QS system of V. harveyi in a dose-dependent manner ( Brackman
et al., 2008 ). In another study, conducted by the same group, it was
reported that cinnamaldehyde, cinnamic acid, 4-methoxicinnamaldehyde,
4-dimethylaminocinnamaldehyde, and 4-phenyl-2-butanone were effective
Eugenol, an active constituent found in essential oils, has been
strated reduction in violacein production in C. violaceum treated with
eugenol. They also observed modulation of lasB and pqsA in E. coli, sug-
gesting that eugenol inhibits Las and pseudomonas quinolone signal
(PQS)Àcontrolled transcription. Recently, it was reported that eugenol
demonstrated significant anti-QS activity in mutant strain C. violaceum
CVO26 and also reduced the QS-regulated production of elastase, prote-
ase, chitinase, pyocyanin, and EPS in P. aeruginosa PAO1 at subinhibitory
eugenol derivative, was observed as the chief phytoconstituent responsible
for the anti-QS activity of Cuminum cyminum extract using molecular
S. aureus, eugenol demonstrated antivirulence property by reducing
exotoxin production. This decreased production of exotoxin is induced
by the repression of agrA transcription and reduced transcription of
317
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds
Phenolics such as 6-gingerol, zingerone, and 6-shogaol exhibited QSI
authors demonstrated that zingerone decreased N-(3-oxododecanoyl)- L -
homoserine lactone molecules and PQS production. Docking analysis
revealed that the compound may interact with active site of QS receptors,
blocking the downstream signaling pathway. Therefore, blockage of
receptorÀligand binding seems to be the mechanism by which zingerone
reduces the expression of QS-regulated virulence genes ( Kumar et al.,
2015 ). QS inhibition by 6-gingerol was confirmed with two biosensor
strains, C. violaceum (reduction in violacein production) and A. tumefaciens
Phenolic component of Curcuma longa root/rhizome, curcumin,
reduced QS signal molecule leading to decreased production of virulence
sion QS-regulated genes involved in transcriptional regulation and in type
III secretion factors. Several other studies have been conducted to explore
reduced violacein production in C. violaceum and inhibition of biolumi-
nescence in V. harveyi after treatment with sub-MICs of curcumin.
12.3.4.5 Quinones
Molecular docking analysis was conducted to screen putative QSIs of
A. tumefaciens from a database of known compounds used in Chinese
traditional medicine. Computational studies identified six potential
QSIs; however, only anthraquinone emodin induced proteolysis of
0
(Z),13
0
(E)-
Heptadecadienylhydroquinone was observed to inhibit QS-regulated
swarming motility in Proteus mirabilis wild type and rppA mutant strains.
This effect was not witnessed in rcsB mutant indicating that this
compound inhibits motility through the RcsB-dependent pathway
12.3.4.6 Stilbenoids
Resveratrol was reported to decrease QS-regulated violacein production
in C. violaceum. In a separate study, it was observed to reduce the AHL
concentrations in Y. enterocolitica and E. carotovora in addition to violacein
reported to interfere with virulence factor production in P. mirabilis
318
New Look to Phytomedicine
12.3.4.7 Tannins
Well-explored tannin ellagic acid interfered with QS of C. violaceum and
reduced synthesis of AHL synthesis in Y. enterocolitica and E. carotovora
acid derivatives from T. chebula (fruit) extract demonstrated inhibition of
QS-regulated production of extracellular virulence in P. aeruginosa. Estes
showed downregulation of AI synthase (lasI and rhlI) and their cognate
was observed to decrease violacein production significantly and reduced
QS-regulated biofilm formation, prodigiosin production, and protease
RNAIII. In all S. aureus and Staphylococcus epidermidis tested, hamamelita-
nin reduced virulence factor production in vitro by downregulating pro-
duction of RNAIII, a component of agr QS system.
Tannic acid, a hydrolysable tannin, is shown to antagonize QS system by
inhibiting violacein production. It was also demonstrated to reduce biofilm
Punicalagin, another well-known tannin, showed reduced production of
violacein at sub-MICs in C. violaceum. Moreover, punicalagin reduced the
12.3.4.8 Terpenoids and Derivatives
Monoterpene, carvacrol, was shown to inhibit cviI gene expression in
C. violaceum; this gene encodes for AHL synthase. Carvacrol reduced the
production after treatment with terpinen-4-ol, linalool, and α-pinene.
Thymol and menthol also demonstrated decreased production of
α-hemolysin, enterotoxin A and B, and toxic shock syndrome in
S. aureus. At the highest concentration tested, thymol and menthol
Menthol was effective in reducing QS-regulated virulence and biofilm
formation in P. aeruginosa and A. hydrophila. Methanol directly inhibited
terpenes α-phellandrene, p-cimene, thymol, carvacol, geraniol,
menthone, linalool, camphene, camphor and the sesquiterpenes farnesol,
nerolidol, and nerol using C. violaceum and P. aeruginosa strains.
319
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds
related compounds geranyllinalool and farnesyl acetate inhibited PQS and
pyocyanin production without affecting growth of the bacteria. Diminuir
in pqsA transcript in P. aeruginosa, that interferes with the PqsR-mediated
transcriptional activation, facilitates the reduction in PQS production.
α-Toxin production in S. aureus is encoded by hla gene under the
control of agr. Sesquiterpene lactone isoalantolactone, α-cyperone,
and triperpene glycyrrhetinic acid inhibited α-toxin production in
12.4 CONCLUSION
The data presented in this document clearly shows that plants and their
metabolites could be exploited in the discovery of novel drugs in order to
combat drug-resistant bacterial infections. The different classes of phyto-
compounds having diverse antivirulence properties are an attractive alter-
native to bacteria resistant to conventional antibiotics. Numerous reports
have suggested that phytocompounds demonstrate bacteriostatic or bacte-
ricidal activity against wide array of pathogenic bacteria using different
mecanismos. In addition to the antibacterial activity, they cause site-
specific modulation of bacterial virulence targets, as shown by their inter-
ference in enzymes, toxins, and signal receptors.
QS has been a leading anti-infective drug target, although complexity
of the system allows distinct cascades to bypass the inhibited pathway. QS
system coordinates many functions in the cells, therefore, any interference
with the QS of the pathogen is bound to alter bacterial fitness. Atual
review brings to the fore the QS inhibitory potential of several com-
pounds of plant origin in different QS systems. These QSIs are safe, sta-
ble, and nontoxic and include low risk of resistance development.
Although these compounds offer great hope in the fight against drug
resistance, but still there is a long way to go. Further, in depth, analysis is
required on bioavailability and pharmacodynamics, and studies demon-
strating the clinical efficacy of promising compounds should be con-
canalizado. It is very important to understand the synergism between
conventional antibiotics and QSIs to make progress in this field. Thus, in
conclusion, it can be said that the phytocompounds are the promising
candidates in the development of antipathogenic drugs, although applica-
bility of this approach remains to be investigated and validated.
320
New Look to Phytomedicine
AGRADECIMENTOS
The authors wish to thank the Pharmacy Research Centre, College of Pharmacy, and the
Deanship of Scientific Research, King Saud University, Riyadh, KSA for funding this
pesquisa.
REFERÊNCIAS
Aliyu, AB, Koorbanally, NA, Moodley, B., Singh, P., Chenia, HY, 2016. Quorum
Al-Yousef, HM, Ahmed, AF, Al-Shabib, NA, Laeeq, S., Khan, RA, Rehman, MT,
0
Autret, N., Raynaud, C., Dubail, I., Berche, P., Charbit, A., 2003. Identification of the
Bacha, K., Tariku, Y., Gebreyesus, F., Zerihun, S., Mohammed, A., Weiland-Bräuer, N.,
Bansal, T., Englert, D., Lee, J., Hegde, M., Wood, TK, Jayaraman, A., 2007. Differential
Bhargava, N., Singh, SP, Sharma, A., Sharma, P., Capalash, N., 2015. Attenuation of
Bodede, O., Shaik, S., Chenia, H., Singh, P., Moodley, R., 2018. Quorum sensing inhibi-
Borges, A., Serra, S., Cristina Abreu, A., Saavedra, MJ, Salgado, A., Simo˜es, M., 2014.
321
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds
Bouhdid, S., Abrini, J., Zhiri, A., Espuny, MJ, Manresa, A., 2009. Investigation of func-
Brackman, G., Defoirdt, T., Miyamoto, C., Bossier, P., Van Calenbergh, S., Nelis, H.,
Brackman, G., Celen, S., Hillaert, U., Van Calenbergh, S., Cos, P., Maes, L., et al., 2011.
Brango-Vanegas, J., Costa, GM, Ortmann, CF, Schenkel, EP, Reginatto, FH, Ramos,
Chen, G., Swem, LR, Swem, DL, Stauff, DL, O'Loughlin, CT, Jeffrey, PD, et al.,
Chong, YM, Yin, WF, Ho, CY, Mustafa, MR, Hadi, AHA, Awang, K., et al.,
Chang, CY, Krishnan, T., Wang, H., Chen, Y., Yin, WF, Chong, YM, et al., 2014.
Cugini, C., Calfee, M., Farrow, JM, Morales, DK, Pesci, EC, Hogan, DA, 2007.
da Silva Trentin, D., Giordani, RB, Zimmer, KR, Da Silva, AG, Da Silva, MV, dos
Defoirdt, T., Boon, N., Sorgeloos, P., Verstraete, W., Bossier, P., 2008. Quorum sensing
Ding, X., Yin, B., Qian, L., Zeng, Z., Yang, Z., Li, H., et al., 2011. Screening for novel
322
New Look to Phytomedicine
Ganin, H., Rayo, J., Amara, N., Levy, N., Krief, P., Meijler, MM, 2013. Sulforaphane
Girennavar, B., Cepeda, ML, Soni, KA, Vikram, A., Jesudhasan, P., Jayaprakasha, GK,
Hentzer, M., Riedel, K., Rasmussen, TB, Heydorn, A., Andersen, JB, Parsek, MR,
Holmstrom, GPC, Kjelleberg, S., 2001. Inhibition of fungi. WO2001068091A1.
Hossain, MA, Lee, SJ, Park, JY, Reza, MA, Kim, TH, Lee, KJ, et al., 2015.
Hossain, MA, Lee, SJ, Park, NH, Mechesso, AF, Birhanu, BT, Kang, J., et al.,
Husain, FM, Ahmad, I., Khan, MS, Ahmad, E., Tahseen, Q., Khan, MS, et al., 2015a.
Husain, FM, Ahmad, I., Al-thubiani, AS, Abulreesh, HH, AlHazza, IM, Aqil, F.,
323
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds
Jakobsen, TH, Bragason, SK, Phipps, RK, Christensen, LD, van Gennip, M.,
Jakobsen, TH, van Gennip, M., Phipps, RK, Shanmugham, MS, Christensen, LD,
Kerekes, EB, Deák, É., Takó, M., Tserennadmid, R., Petkovits, T., Vágvölgyi, C., et al.,
Kiran, MD, Adikesavan, NV, Cirioni, O., Giacometti, A., Silvestri, C., Scalise, G.,
Kumar, L., Chhibber, S., Kumar, R., Kumar, M., Harjai, K., 2015. Zingerone silences
Lee, J., Attila, C., Cirillo, SL, Cirillo, JD, Wood, TK, 2009. Indole and 7-hydroxyin-
Leng, BF, Qiu, JZ, Dai, XH, Dong, J., Wang, JF, Luo, MJ, et al., 2011. Allicin
Li, HE, Qiu, JZ, Yang, ZQ, Dong, J., Wang, JF, Luo, MJ, et al., 2012.
Li, G., Yan, C., Xu, Y., Feng, Y., Wu, Q., Lv, X., et al., 2014. Punicalagin inhibits
324
New Look to Phytomedicine
Liu, MC, Lin, SB, Chien, HF, Wang, WB, Yuan, YH, Hsueh, PR, et al., 2012. 10
0
0
Luo, M., Qiu, J., Zhang, Y., Wang, J., Dong, J., Li, H., et al., 2012. α-Cyperone allevi-
Mitchell, G., Lafrance, M., Boulanger, S., Séguin, DL, Guay, I., Gattuso, M., et al.,
Monte, J., Abreu, AC, Borges, A., Simo˜es, LC, Simo˜es, M., 2014. Antimicrobial activ-
Mueller, RS, Beyhan, S., Saini, SG, Yildiz, FH, Bartlett, DH, 2009. Indole acts as an
Muhs, A., Lyles, JT, Parlet, CP, Nelson, K., Kavanaugh, JS, Horswill, AR, et al.,
Musthafa, KS, Ravi, AV, Annapoorani, A., Packiavathy, ISV, Pandian, SK, 2010.
Natrah, FMI, Alam, MI, Pawar, S., Harzevili, AS, Nevejan, N., Boon, N., et al.,
Novick, RP, Projan, SJ, Kornblum, J., Ross, HF, Ji, G., Kreiswirth, B., et al., 1995.
325
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds
Ohtani, K., Yuan, Y., Hassan, S., Wang, R., Wang, Y., Shimizu, T., 2009. Virulence gene
Oliveira, BDA´., Rodrigues, AC, Cardoso, BMI, Ramos, ALCC, Bertoldi, MC,
Packiavathy, IASV, Agilandeswari, P., Musthafa, KS, Pandian, SK, Ravi, AV, 2012.
Parsek, MR, Val, DL, Hanzelka, BL, Cronan, JE, Greenberg Jr, EP, 1999. Acyl
Qiu, J., Jiang, Y., Xia, L., Xiang, H., Feng, H., Pu, S., et al., 2010a. Sub-inhibitory con-
Qiu, J., Feng, H., Lu, J., Xiang, H., Wang, D., Dong, J., et al., 2010b. Eugenol reduces
Qiu, J., Wang, D., Xiang, H., Feng, H., Jiang, Y., Xia, L., et al., 2010c. Subinhibitory
Qiu, J., Li, H., Meng, H., Hu, C., Li, J., Luo, M., et al., 2011a. Impact of luteolin on the
Qiu, J., Xiang, H., Hu, C., Wang, Q., Dong, J., Li, H., et al., 2011b. Sub-inhibitory con-
Qiu, J., Luo, M., Dong, J., Wang, J., Li, H., Wang, X., et al., 2011c. Menthol diminishes
Qiu, J., Luo, M., Wang, J., Dong, J., Li, H., Leng, B., et al., 2011d. Isoalantolactone protects
Qiu, J., Niu, X., Wang, J., Xing, Y., Leng, B., Dong, J., et al., 2012. Capsaicin protects
326
New Look to Phytomedicine
Rader, BA, Campagna, SR, Semmelhack, MF, Bassler, BL, Guillemin, K., 2007.
Rahman, MRT, Lou, Z., Yu, F., Wang, P., Wang, H., 2017. Anti-quorum sensing and
Rasko, DA, Moreira, CG, Li, R., Reading, NC, Ritchie, JM, Waldor, MK, et al.,
Rasmussen, TB, Skindersoe, ME, Bjarnsholt, T., Phipps, RK, Christensen, KB,
Riedel, CU, Monk, IR, Casey, PG, Waidmann, MS, Gahan, CG, Hill, C., 2009.
Sarkar, R., Chaudhary, S., Sharma, A., Yadav, K., Nema, N., Sekhoachad, M., et al.,
Schaefer, AL, Val, DL, Hanzelka, BL, Cronan, JE, Greenberg, EP, 1996.
Singh, BN, Singh, HB, Singh, A., Singh, BR, Mishra, A., Nautiyal, CS, 2012.
Taganna, JC, Quanico, JP, Perono, RMG, Amor, EC, Rivera, WL, 2011. Tannin-
327
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds
Vandeputte, OM, Kiendrebeogo, M., Rajaonson, S., Diallo, B., Mol, A., El Jaziri, M.,
Vandeputte, OM, Kiendrebeogo, M., Rasamiravaka, T., Stevigny, C., Duez, P.,
Vikram, A., Jayaprakasha, GK, Jesudhasan, PR, Pillai, SD, Patil, BS, 2010.
Wang, WB, Lai, HC, Hsueh, PR, Chiou, RYY, Lin, SB, Liaw, SJ, 2006.
Watson, WT, Minogue, TD, Val, DL, von Bodman, SB, Churchill, ME, 2002.
Wu, H., Song, Z., Hentzer, M., Andersen, JB, Molin, S., Givskov, M., et al., 2004.
Yang, Q., Pande, GSJ, Wang, Z., Lin, B., Rubin, RA, Vora, GJ, et al., 2017. Indole
Zahin, M., Hasan, S., Aqil, F., Khan, MSA, Husain, FM, Ahmad, I., 2010. Screening
Zaki, AA, Shaaban, MI, Hashish, NE, Amer, MA, Lahloub, MF, 2013. Assessment
328
New Look to Phytomedicine
Zhang, RG, Pappas, KM, Brace, JL, Miller, PC, Oulmassov, T., Molyneaux, JM,
Zhou, L., Zheng, H., Tang, Y., Yu, W., Gong, Q., 2013. Eugenol inhibits quorum sens-
329
Current Strategy to Target Bacterial Quorum Sensing and Virulence by Phytocompounds





Original English text:
tors in pathogenic bacteria of different origins is controlled by QS

Contribute a better translation















 Contribute a better translation
Contribute a better translation
