Novo Desenho de Ensaios Clínicos
Sodré Neto
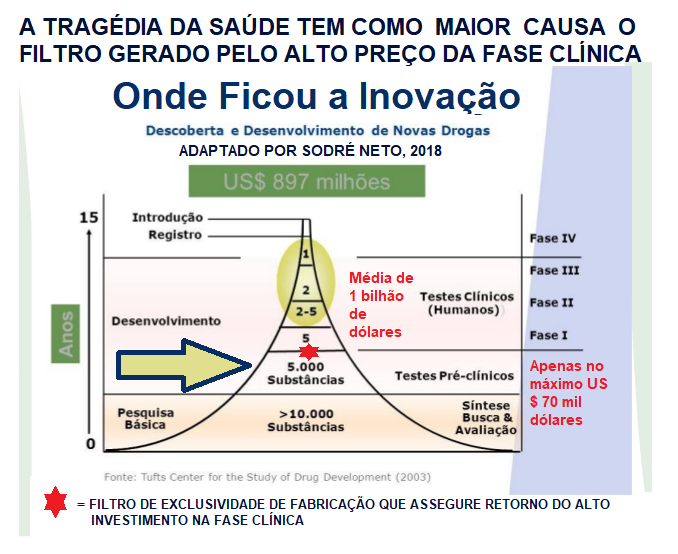
| Resumo: O alto custo de ensaios clínicos (em proporção crescente fases 1 , 2 e 3) além de condenar ao esquecimento ou marginalidade a maior parte das descobertas e inovações científicas , as substitui por projetos em geral venenosos e agressivos que foram viáveis economicamente a industria farmacêutica. A partir da análise deste quadro, propomos soluções urgentes a partir do barateamento das fases clínicas por meio de desenhos adaptativos e cruzados controlados por sistema que conjugue acompanhamento médico unido a pesquisadores e laboratórios envolvidos, e maneira de fazer o Estado compartilhar gastos em saúde em parceria com universidades que atendam parte dos pacientes usando pesquisas promissora inovadoras. |
Assim como as leis podem acabar por fomentar a injustiça quanto mais se afastam do seu principio, os ensaios clínicos quanto mais exigentes podem também ao mesmo tempo impedir marginalizando excelentes soluções em saúde, como recomendar soluções até nocivas apenas por que representam viabilidade econômica, patentes e exclusividade de fabricação, uma vez que somente este perfil permite investimentos para satisfazer as muitas exigências e alto custo da fase clínica.
O processo de P&D de um medicamento é um dos processos mais exigentes, custosos e longos entre todos os setores da economia. Para o lançamento de um único produto novo, pode-se levar mais de dez anos, com investimentos superiores a US$ 1 bilhão1 [PhRMA (2012)]
https://web.bndes.gov.br/bib/jspui/bitstream/1408/1504/2/A%20set.36_Ensaios%20cl%C3%ADnicos%20no%20Brasil.pdf
Isso fez com que pesquisássemos os ensaios clínicos no sentido com um olhar crítico em busca de alguma solução, e verificar até que ponto pode existir possibilidade de os tornarem mais baratos e acessíveis a projetos que satisfaça simplesmente a ciência dos fatos, e não quase que somente ao perfil exigido pelos investidores.
"O patrocínio das pesquisas por indústrias farmacêuticas estrangeiras é importante para o desenvolvimento científico; porém o monopólio da área pode comprometer a credibilidade da pesquisa, considerando-se a existência de fortes conflitos de interesse, de difícil manejo". (http://revistabioetica.cfm.org.br/index.php/revista_bioetica/article/view/1119/1499
No relatório do BDNS, encabeçado por Renata achamos :
https://web.bndes.gov.br/bib/jspui/bitstream/1408/1504/2/A%20set.36_Ensaios%20cl%C3%ADnicos%20no%20Brasil.pdf
"Em razão das mudanças ocorridas no processo de P&D da indústria farmacêutica, as abordagens tradicionais de condução de testes clínicos, no entanto, não têm se mostrado tão eficientes. Em função da quantidade de dados gerados durante a execução do teste, há uma tendência recente de adotar abordagens flexíveis e adaptativas, que permitam utilizá-los para melhorar continuamente o estudo. O Estudo Adaptativo é uma abordagem em que os dados são avaliados uma ou múltiplas vezes ao longo da execução do protocolo, de forma a verificar a possibilidade de alterar a forma de condução do estudo. Em função de novas tecnologias de seleção existentes, é possível ter mais conhecimento sobre eficácia e segurança de um medicamento, o que permite melhorias periódicas nos testes ou encerramento dos estudos que se mostrem não efetivos mais cedo, possibilitando reduções substanciais nos gastos e no tempo despendido. É importante ressaltar, contudo, que a gestão desses estudos é mais complexa e exige monitoramento mais frequente, maior controle dos dados, agilidade e flexibilidade das instituições. Dessa forma, apesar de atraente, a mudança para o desenho adaptativo não é tarefa trivial para a indústria e para o regulador, principalmente em países em que não há experiência acumulada e tradição no desenho de protocolos. A Food and Drug Administration (FDA), órgão regulador americano, tem apoiado novos desenhos que visem tornar os testes clínicos mais efetivos, como é o caso dos testes adaptativos. Além de rever os desenhos adotados pelas empresas, a agência decidiu, recentemente, elaborar documentos de orientação para a indústria farmacêutica e de biotecnologia de forma a regulamentar e facilitar a adoção desse tipo de desenho.
Identificado o problema e uma possivel solução ao propor desenhos adaptativos , vimos aqui propor uma solução descrita no video
Lista de estudos, ensaios, pesquisas, remédios e protocolos que podem ser contemplados pelo novo sistema
1. Em fase clinica 1 ou 2 no exterior
2. Biossemelhantes
3. Produtos naturais usados por milênios ou décadas por humanos e que foram apenas confirmados em fase pré-clinica em animais
4. Produtos que imitam componentes naturais desde que apresentem teste de espectrometria de massas quantificando teor de principio ativo comparado a baixos índices de subprodutos sintéticos que acabam ocorrendo nos plágios sintéticos
5.
Encaminhar a revista http://revistabioetica.cfm.org.br
