Open Access
Int. J. Mol. Sci. 2018 , 19 (11), 3568; https://doi.org/10.3390/ijms19113568
Reveja
Targeting Cancer with Phytochemicals via Their Fine Tuning of the Cell Survival Signaling Pathways
1
Department of Neuroscience, Biomedicine and Movement Sciences, University of Verona, 37134 Verona, Italy
2
Scientific Secretary-Council for Nutritional and Environmental Medicine (CONEM), 8610 Mo i Rana, Norway
3
Council for Nutritional and Environmental Medicine (CONEM), 8610 Mo i Rana, Norway
4
Department of Pharmacognosy and Botany, DanyloHalytskyLviv National Medical University, 79007 Lviv, Ukraine
5
AOUI Verona, Hospital Universitário, Seção de Imunologia, 37134 Verona, Itália
6
Departamento de Química de Compostos Naturais, Universidade Nacional de Farmácia, 61168 Kharkiv, Ucrânia
7
Departamento de Farmacognosia, Universidade Nacional de Farmácia, 61168 Kharkiv, Ucrânia
*
Autor a quem a correspondência deve ser endereçada.
Recebido: 26 de outubro de 2018 / Aceito: 9 de novembro de 2018 / Publicado em: 12 de novembro de 2018
Resumo
:O papel dos fitoquímicos como potenciais pró-fármacos ou substâncias terapêuticas contra tumores tornou-se destaque nos anos muito recentes, graças à enorme massa de resultados encorajadores e promissores da atividade in vitro de muitos compostos fenólicos de extratos vegetais crus contra muitas células cancerígenas. linhas. Evidências pequenas, mas importantes, podem ser recuperadas da literatura científica clínica e nutricional, na qual os flavonóides são investigados como principais compostos pró-apoptóticos e anti-metastáticos. No entanto, o real papel desses compostos no câncer ainda está longe de ser totalmente elucidado. Muitos destes fitoquímicos agem de maneira pleiotrópica e pouco específica, mas, mais importante, eles são capazes de ajustar a sinalização de espécies reativas de oxigênio (EROs) para ativar uma sobrevivência ou um mecanismo pró-autofágico e pró-apoptose, dependendo da dotação responsiva ao estresse oxidativo da célula alvo. Esta revisão tentará se concentrar nessa questão.
Palavras-chave:
fitoquicos; flavonóides; Câncer; mitocôndria; apoptose1. Introdução
A capacidade dos fitoquímicos para prevenir o câncer tem sido reivindicada há muito tempo como o potencial mais notável dessas moléculas derivadas de plantas, apesar do fato de que a maior parte dessas substâncias é composta de compostos tóxicos [ 1 , 2 , 3 , 4 ]. No entanto, a suposta atividade anticancerígena de muitos compostos fenólicos produzidos no mundo natural, representando mais de 5000 compostos quimicamente caracterizados diferentes em plantas comestíveis [ 5 ], foi descrita como fundamentalmente dependente da sua propriedade antioxidante [ 6 ]. Não obstante, a capacidade dos fitoquímicos em induzir a expressão da via de sinalização Nrf2-ARE [ 7 , 8 , 9], apesar da evidência de que todos os estressores podem ativar o sistema Nrf2-ARE [ 10 ], o potencial dessas substâncias fenólicas derivadas de plantas para promover, potencializar e desencadear a expressão e a atividade da superóxido dismutase (SOD), catalase (CAT) e glutationa peroxidase (GPX) [ 11 ], representam uma marca fundamental para confiar nessas substâncias como possíveis moléculas quimiopreventivas [ 12 , 13 , 14 , 15 , 16 ]. Como os fitoquímicos podem neutralizar os tumores ainda está longe de ser totalmente elucidado. Os fitoquímicos têm uma enorme panóplia de alvos intracelulares e sua interação com muitos deles ainda é intrigante e particularmente intrigante [ 17].]. Uma primeira questão a ser enfocada é a relação entre mitocôndrias, espécies reativas de oxigênio (ROS) e câncer [ 18 , 19 , 20 , 21 ]. Fitoestrogênios derivados de plantas, como catequinas, podem induzir biogênese mitocondrial, restaurando assim a função mitocondrial, através da indução de sistemas de sinalização de sobrevivência ativados durante mitohormesis, como AMPK / AAK-2, SIRT1 / SIR-2.1 e FOXO / DAF-16, em C. elegans [ 22]. As mitocôndrias alvo devem demonstrar também a capacidade dessas moléculas para sintonizar a morfogênese celular e melhorar a função e biogênese das mitocôndrias [ 23 , 24 , 25]. Na verdade, alterações na dinâmica mitocondrial modulam alguns tipos de tumores. Por exemplo, a fusão mitocondrial desregulada por knockdowns Mfn2 suprime a taxa de consumo de oxigênio em células de melanoma, sugerindo que a dinâmica mitocondrial, ou seja, a taxa de fissão e fusão, modulam a migração e progressão celular nesse tipo de câncer [ 26 ]. A di-hidromicetina é capaz de reverter a disfunção mitocondrial, que deve ser mediada pelas vias de sinalização PGC-1α / TFAM e PGC-1α / mfn2, melhorando, portanto, a dinâmica das mitocôndrias [ 27 ]. A disfunção das mitocôndrias é uma característica típica de muitos tipos de câncer e a habilidade dos fitoquímicos em restaurá-la parece bastante fundamental [ 28 , 29 , 30].]. A regulação definitiva do processo de sobrevivência em uma célula envolve uma série de vias de sinalização que não só englobam a doação enzimática para a eliminação de EROs, mas também a complexa modulação de maquinaria do crosstalk entre mitocôndrias e outras organelas levando ao equilíbrio da autofagia / apoptose [ 31 , 32 , 33 ].
Os fitoquímicos não só podem neutralizar a malignidade e a progressão do câncer, mas podem induzir a necrose, além da apoptose das células tumorais [ 36 , 37 ]. Além disso, o papel da autofagia no desenvolvimento do câncer foi extensivamente revisado nos últimos anos [ 38 ]. Embora a autofagia levasse a uma supressão da tumorigênese, algumas circunstâncias mostraram uma ação oposta ao câncer [ 38 , 39 ]. Portanto, a capacidade dos fitoquímicos de visar a autofagia celular como uma abordagem na utilização de substâncias naturais como compostos quimiopreventivos deve ser considerada com especial atenção, apesar dos muitos resultados encorajadores [ 40 , 41 , 42]. Sua atividade também pode ter como alvo a sinalização intracelular de cálcio e o estresse do retículo endoplasmático (ER) [ 43 , 44 ], que exerce um papel importante no ajuste mediado pelas mitocôndrias das muitas funções de sobrevivência celular [ 45 ]. Um papel na manutenção da homeostase de estresse mitocondrial-ER tem sido recentemente atribuído a proteases Lon (LONPs), onde LONP é um complexo proteico feito por uma estrutura homo-hexamérica em forma de anel com uma dupla catalítica serina-lisina, que é altamente conservada em ambos os organismos procarióticos e eucarióticos [ 46 , 47 ]. As LONPs são reguladas positivamente durante o estresse do ER, através da ativação da via de sinalização PERK-ATF4 [ 48 , 49], que pode ser alvo de flavonóides [ 50 , 51 , 52 ]. Nesta perspectiva, os polifenóis derivados de plantas podem ter como alvo muitos sistemas de sinalização celular anti-oxidantes, que exercem um papel importante na biogênese das mitocôndrias e na homeostase de estresse de ER-mitocôndrias. A estreita interação entre mitocôndrias e ER pode ser regulada pela caveolina-1, localizada na interface mitocôndria / ER, onde prejudica a remodelação da relação mitocôndria-ER, tornando as mitocôndrias não responsivas ao estresse de ER através do amortecimento da sinalização de cálcio. [ 53 , 54 ]. Este mecanismo é contrabalançado pela sinalização mediada por PKA-DRP1 [ 54 , 55 ], que é alvo de flavonóides [56 ]. Nas células cancerígenas, essa homeostase pode ser profundamente perturbada e a atividade dos flavonóides pode ser funcionalmente invertida em relação àquela que atua sobre células normais não cancerosas [ 57 ]. Na verdade, os tumores têm uma resposta ao estresse diferente em relação às células não tumorais, de modo que qualquer abordagem terapêutica deve levar em conta essa questão [ 58 , 59 ].
Nesta revisão, tentaremos elucidar as novidades muito recentes no campo da prevenção e terapia do câncer usando fitoquímicos derivados da natureza.
2. Insights sobre o papel dos flavonóides no câncer
2.1. Flavonóides e Apoptose
A Tabela 1 resume alguns dos resultados muito recentes sobre a capacidade dos flavonóides na inibição do desenvolvimento de câncer e malignidade [ 60 , 61 , 62 , 63 , 64 , 65 , 66 , 67 , 68 , 69 , 70 , 71 , 72 , 73 , 74 , 75 , 76 , 77 , 78 , 79 , 80 , 81 , 82 , 83 ,84 , 85 , 86 , 87 ]. Muitas dessas moléculas agem contra as células cancerosas, promovendo e ativando a apoptose. As vias de sinalização através das quais os flavonóides induzem a apoptose em células cancerígenas são várias. Além do efeito sobre Bax, Bcl-2 e caspases, uma possibilidade adicional é representada pela inibição da sintase dos ácidos graxos (FAS) exercida por um grande número de flavonóides, como epigalocatequina-3-galato (EGCG), luteolina, quercetina, kaempferol, apigenina e taxifolina, que exercem suas atividades anti-lipogênicas contra muitos tumores humanos [ 88 , 89]. A FAS é superexpressa em muitos cânceres epiteliais humanos e também em tumores de mama. Sua inibição, causando o acúmulo de malonil-CoA, leva à supra-regulação dos níveis de ceramida e à inibição da carnitina palmitoiltransferase-1, induzindo a expressão dos genes pró-apoptóticos BNP3, TRAIL e DAPK2 e causando apoptose [ 90 ]. Curiosamente, a inibição FAS provoca uma enorme regulação positiva de ROS, que tem sido relatada como um fator chave na promoção da apoptose de células cancerígenas, curiosamente sugerindo que os antioxidantes promovem o estresse oxidativo para matar células cancerígenas [ 91 ]. Na verdade, os flavonóides inibem a apoptose em células não cancerosas, provavelmente por causa de sua indução de eustress e, consequentemente, da resposta de sobrevivência das células [ 17 , 92].], um mecanismo que depende muito da dose de flavonóides [ 93 ] e sua interação com as ERO como moléculas sinalizadoras [ 17 , 94 ]. Células cancerosas são caracterizadas por um alto grau de estresse oxidativo e produção de ROS, e possuem uma alta atividade metabólica e peroxissérmica, freqüentemente levando à disfunção mitocondrial e uma atividade aumentada de lipoxigenases, timidina fosforilases, oxidases e ciclooxigenases [ 95 ]. No entanto, apesar da necessidade esperada nas enzimas de eliminação de ROS, os flavonóides exercem a sua actividade anticancerígena muito raramente com o único aumento na maquinaria anti-oxidante. Mecanismos acoplados mais complexos ocorreriam. Por exemplo, a esculetina e a quercetina atuam no ajuste fino da homeostase redox em células de leucemia NB4 [96 ]. Paradoxalmente, 25 μM de quercetina aumentaram o NF-κB p65 no núcleo e reduziram-no no citosol, enquanto reduziram Nrf2 no núcleo e o aumentaram no citosol [ 96 ]. Além disso, a esculetina, em contraste com a quercetina, aumenta o nível da expressão da superóxido dismutase (SOD) [ 96 ]. Um ajuste fino na célula, onde os flavonóides podem exercer uma ação aparentemente contraditória, existe. Além disso, a hipótese de que o câncer pode estar intimamente associado a um desequilíbrio na energia homeostase, incluindo também a sinalização de ROS e a oscilação das mitocôndrias, foi recentemente abordada [ 17 , 97 ].
Tabela 1. Alguns dos exemplos muito recentes dos papéis exercidos pelos flavonóides nas células cancerígenas.
A maioria dos flavonóides desencadeia as vias apoptóticas nas células cancerosas através de suas vias fundamentais de sinalização. O análogo de isoflavona fenoxodiol induz a apoptose no câncer renal pela inibição da via de Akt, enquanto que a apoptose é induzida em células não cancerosas por fosforilação de Akt [ 98 , 99 ]. A indução de apoptose em células cancerígenas através da via de sinalização PI3K / Akt é sustentada por um amplo espectro de fitoquímicos. A luteolina induz apoptose dependente de caspases no carcinoma hepatocelular humano pela inibição da fosforilação de Akt [ 100 ], e a icanina de flavonol glucosídeo (40 μM) induz a apoptose via dano mediado por ROS no potencial de membrana mitocondrial suprimindo a sinalização PI3K / Akt e STAT3 caminhos [ 101]. Além disso, a baicaleína, ao agir sobre a PI3K / Akt / NF-kB, aumenta a sensibilidade à cisplatina da linhagem celular de adenocarcinoma de pulmão A549 [ 102 ] .Flavonóides, agindo nas células via PI3K / Akt, devem regular a sobrevivência celular e a apoptose em um nível pós-mitocondrial, isto é, a jusante da liberação mitocôndrica do citocromo c e antes da ativação da caspase 9 [ 103 ]. As EROs têm um papel fundamental na sinalização mediada por Akt que leva à apoptose, pois ativam a via Akt / ASK1 / p38MAPK, modulando a desfosforilação da ASK1, que subseqüentemente ativa p38MAPK e regula negativamente p21 (Cip1), levando à apoptose [ 104 , 105]. A capacidade dos flavonóides para causar apoptose em células cancerosas através da via de Akt pode ser paradoxalmente mediada por um rápido desequilíbrio na homeostase intracelular de ROS ou, mais provavelmente, pela complexa relação entre ASK1 e NF-kB, onde IKK tem um controle importante sobre o eixo ASK1-JNK, associando IKK com ROS e ER stress [ 106 ]. Na verdade, apesar da crença anterior sobre o aumento geral da expressão de NF-κB no câncer, relatos recentes mostraram que tumores diferencialmente expressam subunidades específicas da via do NF-κB, sugerindo a possível existência de um ajuste finamente regulado para a apoptose por diferentes flavonóides em diferentes células alvo [ 107]. Na verdade, 3,4 ', 7-O-trimetil quercetina, um derivado da quercetina, induz a apoptose em linhagens celulares de câncer de ovário CRL-1978, CRL-11731, SK-OV-3, seguindo três diferentes vias-alvo, dependendo da célula tipo [ 108 ].
O amplo conhecimento sobre flavonóides no câncer é que esses compostos são geralmente muito capazes de ter atividades anti-oxidantes e antiinflamatórias, para induzir enzimas de eliminação de ROS e detoxicificação mediada por CYP, para induzir a parada do ciclo celular, apoptose e autofagia, e inibir a proliferação, migração e malignidade [ 109 ]. A apoptose é geralmente ativada por perturbar o equilíbrio de estresse mitocondrial - ER e a homeostase das EROs, acessando esse mecanismo por meio da inibição de muitas vias de sobrevivência. Na verdade, as vias pelas quais os flavonóides induzem a apoptose estão relacionadas aos processos de sobrevivência celular. A glabridina causa apoptose em células de câncer oral via via JNK1 / 2, que com NF-κB está envolvida na sobrevivência celular, apoptose, inflamação e angiogênese [ 110,111 ]; a hesperedina induz a apoptose no carcinoma endometrial por regulao negativa da relao do receptor de estrogio atrav da via de ERK / MAPK [ 112 ]; apigenina desencadeia apoptose e autofagia em células de carcinoma hepatocelular através da via de sinalização PI3K / Akt / mTOR [ 113 ]; A crisina e outros componentes fundamentais da própolis, como os ácidos fenólicos cafeico, ferúlico e ácido α-cumárico, induzem uma apoptose dependente de prolina desidrogenase / prolina oxidase no carcinoma de célula escamosa de tónus humano [ 114 ]. A panóplia de diferentes alvos pelos quais os flavonóides induzem a apoptose pode ser uma consequência do seu papel modulatório no equilíbrio da relação apoptose / necrose [ 115 ].
Pesquisas sobre apoptose e autofagia causadas por fitoquímicos parecem estar polarizadas principalmente em certos tipos de câncer, isto é, câncer de mama, próstata e cólon e mais freqüentemente envolvendo curcumina, flavonóides e resveratrol [ 116 ]. A curcumina e o resveratrol também induzem a apoptose através das mesmas vias de sobrevivência visadas por vários flavonóides, por exemplo, PI3K / Akt [ 117 , 118 ], MAPK / JAK2 / STAT3 [ 119 , 120 ], p38MAPK / ERK1 / 2 / JNK [ 121 , 122 ] , Wnt / β-catenina [ 123 , 124 ], NF-κB [ 125 , 126]. Além dessas principais vias, os fitoquímicos são capazes de induzir a apoptose em células cancerígenas, visando muitos outros mecanismos bioquímicos e de sinalização. Por exemplo, o resveratrol é capaz de atingir a proteína inibidora de FLICE celular (c-FLIP), que é um sintonizador mestre na inibição da apoptose com os receptores de morte TNF-R1, Dr5, DR4 e Fas. Em células de câncer de pulmão, o resveratrol causa down-regulation de p-Akt e c-FLIP, induzindo apoptose junto com um aumento na produção de LOS e Bid induzida por peróxido de hidrogênio, ativação de PARP e caspase 8 e downregulation de pEGFR e proteína NF-κB expressão [ 127 , 128 ].
A via mais comum pela qual os flavonóides induzem a apoptose em células cancerígenas, ie, a via PI3K / Akt, é provavelmente o principal mecanismo de sinalização que leva à expressão gênica de sobrevivência celular com diferentes abordagens, por exemplo, PI3K / Akt / Raf1 / MEK / ERK [ 129 , 130 ], PI3K / Akt / mTOR [ 131 ] e PI3K / Akt / ERK1-2 / NF-kB [ 132 ]. Além disso, a flavonóide irigenina tem como alvo a via de sinalização TRAIL levando à apoptose no câncer gástrico, com o aumento da proteína FAS-associado com o domínio da morte (FADD), receptor de morte 5 (DR5) e proteínas proapoptóticas Bax [ 133 ]. por pinostrobina [ 134 ], apigenina [ 135 ], kaempferol [ 136 ].
A Figura 1 mostra as principais vias visadas pelos flavonóides, cumarinas e estilbenos (resveratrol) na indução da apoptose no câncer de células.
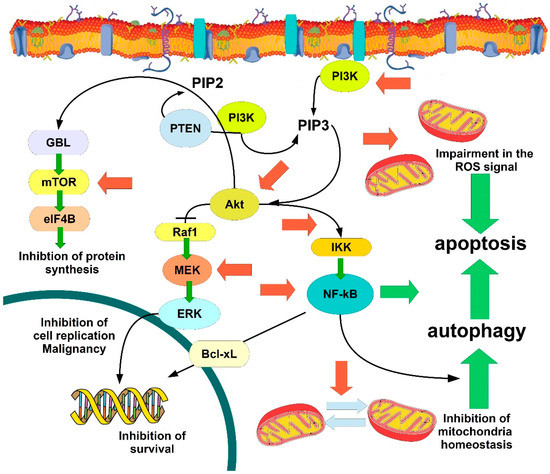
Figura 1. Desenhos animados mostrando as principais vias de sinalização direcionadas por fitoquímicos no câncer. Os fitoquímicos atuam principalmente como inibidores que as setas vermelhas indicam na via de sinalização PI3K / Akt. Setas verdes indicam a ação promovida ou ativada por flavonóides, seguindo também as cascatas de sinalização inibitória. Para detalhes e acrônimos, veja o texto.
2.2. Autofagia e Mitocôndrias - Relação de Estresse por ER Levando à Morte Celular
Os flavonóides podem ter como alvo a maquinaria autofágica nas células cancerígenas, portanto, administrar e governar os processos homeostáticos de sobrevivência, contudo, muitas vezes leva ao destino apoptótico das células tumorais [ 116 ]. Por exemplo, o kaempferol induz a autofagia a regular o miR-340 em células de câncer de pulmão humano [ 41 ] também através da via IRE-JNK-CHOP [ 137 ]. A actividade mais vasto de flavonóides sobre a apoptose em células cancerosas através das principais vias de sinalizao de sobrevivcia que levantam a questão sobre a qual existe relação entre a autofagia e apoptose [ 138 ], embora uma ligação fundamental com a via de sinalização de Akt foi recentemente destacadas [ 139] e alguns componentes importantes da maquinaria de fusão e fissão nas mitocôndrias, ou seja, proteína 1 relacionada à dinamina (Drp1), mitofusina 1/2 (Mfn1 / 2) e Atrofia Óptica 1 (OPA1), foram relatados como envolvidos nas mitocôndrias. modulação relacionada de autofagia, além de apoptose e necroptose [ 140 ]. Os flavonóides podem atuar no crosstalk, levando ao mecanismo de autofagia de sobrevivência ou à decisão de autofagia-apoptose [ 141 , 142 , 143 ], em que um possível papel é exercido por beclin-1, Bcl-2 e Bcl-xL [ 144 , 145 ]. . Além disso, a regulação da mitofagia e da autofagia depende da acetilação (ver acetilCoA) e da acetilação de Lys nas mitocôndrias, sendo responsável por um rigoroso controle na captação de nutrientes [146 , 147 ]. A autofagia pode participar na erradicação do câncer; por exemplo, a silibinina induz a morte das células do câncer de mama MCF7 através da regulação positiva da formação de beclin-1 e Atg12-Atg5, a conversão da cadeia leve 3 (LC3) -I para LC3-II, vazamento mitocondrial do potencial transmembrana mitocondrial e um declínio em níveis de ATP, junto com um grande aumento em ROS [ 148 ].
O papel da autofagia no câncer foi extensivamente revisado [ 149 , 150 ]. A autofagia é um regulador chave da sobrevivência celular e da homeostase, e relatos anteriores sugeriram seu papel como um supressor de tumor. No entanto, uma hipótese pela qual a autofagia leva à tumorigênese tem sido relacionada à sua redução na capacidade de resposta ao estresse, levando a muito mais apoio no metabolismo celular e nos processos de sobrevivência [ 149 ]. Células cancerosas são mais dependentes de autofagia do que outras células. O aumento anormal da demanda metabólica muda a autofagia em direção a mecanismos, levando à apoptose ou à parada do ciclo celular. Particularmente para cânceres induzidos por RAS, relatos recentes sugerem que eles são “viciados em autofagia” [ 151 , 152]. Curiosamente, o flavonóide 6-C- (E-feniletenil) naringenina (6-CEPN), que pode ser encontrado em carne frita fortificada com naringenina, induz autofagia citoprotetora em células de câncer de cólon, embora inibe o crescimento celular por amortecer a expressão de autofagia proteínas Atg7 e beclin-1. O composto 6-CEPN ativa fortemente o RAS [ 153 ]. Outros flavonóides matam as células cancerígenas através de uma via de sinalização autofágica. A flavona é nociva a indução de autofagia no câncer de hepatoblastoma, ativando a sinalização de EROs levando à expressão da p53 e, assim, simultaneamente, ativa a apoptose pelas vias de sinalização PI3K / Akt, JNK e p38MAPK [ 154]. A indução de sinalização de EROs para resultar em apoptose de células cancerosas, através do processo autofágico inicial, também foi relatada para o flavonóide wogonosídeo em células de glioblastoma humano [ 155 ]. Curiosamente, parece que os flavonóides não exercem seu reconhecido potencial antioxidante no câncer; no entanto, uma possível razão é que eles mudam a curva hormética da homeostase da sobrevivência no câncer para um sinal apoptótico dirigido por autofagia, em vez de um processo de sobrevivência dirigido por autofagia.
Possíveis alvos sensíveis deste mecanismo mediado pelos flavonóides “pró-oxidantes” são as mitocôndrias, frequentemente associadas ao estresse de ER e à resposta protéica desdobrada (RPU) [ 156 ].
A morusina flavonóide prenilada induz um aumento nos níveis de íons cálcio mitocondriais, com estresse ER, indução de ROS e perda do potencial de membrana mitocondrial no câncer de ovário epitelial [ 157 ]. A sobrecarga de cálcio na mitocôndria induz inchaço e disfunção mitocondrial, levando à morte celular semelhante à paraptose induzida pela morusina [ 157 ]. A paraptose é um mecanismo que leva à morte celular tumoral, que é diferente da apoptose e necrose [ 158 ]. Alguns flavonóides induzem a paraptose nas células cancerígenas. Por exemplo, o polifenol xanthohumol induz a paraptose em células de leucemia através da via p38MAPK [ 159], a hesperidina, da mesma forma que a morfina, causa a paraptose nas células HepG2, induzindo uma sobrecarga de cálcio nas mitocôndrias e, subsequentemente, disfunção das mitocôndrias [ 160 ]. Além disso, um possível ajuste finamente controlado da homeostase da sobrevivência celular / morte celular deve explicar termos como a paraptose e a necroptose e sua relação com a autofagia [ 161 ].
Os flavonóides podem atuar no crosstalk entre a sobrevivência e a morte celular, atuando como moléculas antioxidantes ou pró-oxidantes, dependendo da dotação responsiva ao estresse da célula perturbada. Certamente, a função orquestrada do proteassoma mitocondrial / ER pode desempenhar um papel importante [ 17 , 53 , 162 , 163 , 164 , 165 ].
2.3. Transição Mesenquimal Epitelial (EMT) e Parada do Ciclo Celular
Muitos fitoquímicos, como flavonóides, induzem a morte de células cancerígenas, visando as vias de EMT celular. A nobiletin, uma hexametoxiflavona, inibe o processo EMT iniciado pela hipóxia no carcinoma de células renais via NF-κB e as vias de sinalização Wnt / β, amortecendo a migração do câncer e a invasão (malignidade) [ 166 ]. O efeito sobre a EMT e, portanto, sobre a migração do câncer também pode estar associado à indução da apoptose [ 167 ] e, mesmo inicialmente visando os mesmos sistemas de sinalização, leva à apoptose, como as vias relacionadas à Akt. Por exemplo, a apigenina inibe a metástase do câncer de pulmão de células não pequenas ao atenuar o sinal EMT através de uma via de sinalização CD26-Akt-Snail / Slug [ 168]. Além disso, a via de sinalização PI3K / Akt pode levar à parada do ciclo celular no câncer [ 101 ]. A cardamonina calcóide induz apoptose e parada do ciclo celular no câncer de mama pela regulação negativa da EMT por Wnt3a / β-catenina, bloqueando a EMT e atenuando o sinal metastático [ 169 ]. Apesar da tentativa de induzir a sobrevivência celular, por exemplo, pela fosforilação de algumas moléculas sinalizadoras, como ERK, as células cancerígenas podem sofrer citotoxicidade dos flavonóides, o que inibe a metástase induzida pela EMT e bloqueia o ciclo celular [ 170 ]. A atividade dos fitoquímicos é fundamentalmente feita de natureza pró-tóxica; As células normais têm a capacidade de neutralizar seu potencial pró-oxidante, enquanto as células cancerígenas não.
As ERO estão intimamente associadas à EMT nas células e a regulação redox na progressão do câncer relacionada à EMT é uma questão de grande interesse [ 171 , 172 , 173 ]. Pode-se pensar que os flavonóides podem até “usar” sua capacidade antioxidante para inibir o EMT induzido por ROS no câncer. No entanto, foi recentemente relatado que a superóxido dismutase promove a EMT, aumentando a metástase do tumor, em células de câncer de pâncreas através do eixo de sinalização H 2 O 2 / ERK / NF-κB [ 174]. É particularmente difícil associar os flavonóides ao seu potencial quimiopreventivo e anticancerígeno, simplesmente recuperando esta relação da sua capacidade antioxidante amplamente divulgada. Um possível sintonizador mestre é o equilíbrio oscilatório das mitocôndrias de sua biogênese, que governa qualquer controle de sobrevivência e também afeta EMT [ 175 , 176 , 177].]. As ROS podem exercer um papel fundamental no balanceamento de sinais. Quando as células estão estressadas metabolicamente e são direcionadas ao comprometimento das mitocôndrias, o risco de sobrecarga de cálcio mitocondrial, estresse de ER com UPR e assim por diante, o estresse moderado com ROS deve funcionar como um sinal para induzir a sobrevivência, mas simplesmente bloquear ou interromper a autofagia, mitofagia ou EMT , levando à apoptose ou parada do ciclo celular. Quando o metabolismo celular e a bioenergética são controlados homeostaticamente, as ERO leves induzem o processo de sobrevivência e restauram o equilíbrio homeostático. No caso das células cancerígenas, a resposta homeostática é sustentada por uma relação incomum de sobrevida entre autofagia e sobrevida, impulsionada pelo sofrimento das EROs e pela EMT. Estresse leve (eustresse), quebrando esse equilíbrio "insano", deve levar à morte celular e à inibição da EMT.
2.4. Insights sobre a capacidade de alimentos crus e extratos vegetais que contêm fitoquímicos para prevenir e combater o câncer
A capacidade dos fitoquímicos para neutralizar o câncer tem sido particularmente enfatizada na atual pesquisa in vitro e na vivoresearch [ 178 ]. A ingestão regular de plantas alimentícias está há muito tempo associada à redução do risco de desenvolver câncer. Uma grande parte das mais de 200 investigações de pesquisa pode ser recuperada da literatura científica atual, relatando a associação entre vegetais e consumo de frutas e a prevenção dos cânceres mais comuns e difusos em humanos, incluindo a recente pesquisa revisada [ 179 ]. De acordo com este estudo, o efeito protetor de substâncias derivadas de plantas na dieta diária, expresso como risco relativo, foi avaliado em pelo menos 128 de 156 investigações nutricionais [ 179]. Para a maioria dos cânceres investigados, as pessoas que consomem dietas moderadas ou pouco enriquecidas com frutas ou vegetais sofreram um risco dobrado de desenvolver câncer em comparação com pessoas com hábitos alimentares, incluindo alimentos crus derivados de plantas, mesmo considerando estatísticas com fatores de confusão. No caso do câncer de pulmão, pelo menos 24 dos 25 estudos recuperados nos últimos anos relataram proteção das plantas, após a remoção de fatores de confusão para o tabagismo [ 179 ]. Cerca de 28 dos 29 artigos relataram que o consumo de frutas reduziu a incidência de câncer na cavidade oral, esôfago e laringe, 26 de 30 artigos relataram que o consumo de frutas diminuiu a incidência de câncer de pâncreas e estômago e 28 de 38 artigos revelaram a diminuição do câncer de bexiga e câncer colorretal por ingestão de frutas [ 179]. Além disso, cerca de 11 dos 13 resultados dos estudos são positivos para câncer de endométrio, cérvix e ovário, enquanto o efeito protetor da ingestão de frutas e vegetais foi avaliado também para câncer de mama em uma metanálise realizada [ 179 ]. Esses dados sugerem que boas prevenções de câncer devem exigir a ingestão diária de alimentos crus derivados de plantas [ 179 ]. Apesar dos muitos resultados positivos e encorajadores em investigações in vitro com flavonóides agliconas purificados, os alimentos crus são dotados de uma ação aditiva e sinérgica dos muitos componentes fenólicos diferentes nas matrizes brutas, mostrando uma melhor eficácia na prevenção do câncer [ 5].
Os flavonóides, como uma classe principal de compostos fenólicos, exibiram uma atividade altamente antioxidante. Estes compostos foram ligados para reduzir o risco de doenças crônicas principais e foram reconhecidos em grande parte em frutas, vegetais e outros alimentos vegetais [ 180 ]. Por exemplo, os indígenas que vivem nas áreas da Sibéria possuem uma tradição socioeconômica e antropológica típica, que permite que as pessoas usem um determinado tipo de dieta com alimentos crus vegetais. Os teores de fenólicos, flavonóides, elementos e ácidos orgânicos, atividade antioxidante e citotóxica de seis frutos indígenas siberianos foram estudados recentemente [ 181]. A citotoxicidade celular da linha celular de cancro da próstata humano Du-145 foi realizada tratando a linha celular com pelo menos seis extractos de plantas diferentes de frutos siberianos, abrangendo o intervalo de concentração de 0-100 µg / mL. Damasco siberiano, cinza de montanha da Sibéria e cereja-das-aves-da-siberiana apresentaram moderado efeito citotóxico de forma dose-dependente. Os extratos de damasco siberiano causaram 50% do efeito citotóxico a 25 μg / mL e quase 100% a 100 μg / mL [ 181 ].
Algumas enzimas são particularmente visadas pelos flavonóides contidos nos frutos siberianos. Por exemplo, as ciclo-oxigenases (COXs), que desempenham um papel importante nas reações inflamatórias e na carcinogênese, além de modularem a apoptose celular, a proliferação e os mecanismos angiogênicos nos tecidos, são possíveis alvos desses flavonóides. Por exemplo, antocianinas em frutos de cereja visam COXs, exibindo uma atividade anti-inflamatória [ 182]. Extratos de cereja são considerados bons candidatos para inibir atividades pró-inflamatórias e pró-carcinogênicas da COX. Com seu sabor doce e azedo, frutas cereja são um alimento reconhecido usado pela Sibéria para promover sua boa saúde. As cerejas contêm uma enorme quantidade de antocianinas e anticaninas, misturadas com ácidos fenólicos. A ingestão freqüente e regular desses frutos parece particularmente benéfica na redução da incidência de certos tipos de câncer. O estudo sobre a peroxidação lipídica e sobre a atividade de COXs por flavonóides de diferentes variedades de doces e azedos de cerejas siberianas avaliou o papel desses compostos como inibidores naturais [ 182]. O papel das antocianinas de cereja para a prevenção do câncer de cólon foi confirmado em outro estudo usando uma combinação de extrato rico em antocianina na dieta e dosagens sub-ótimas de sulindaco em camundongos por 19 semanas [ 183 ]. O extrato alcoólico de folhas de cereja contendo flavonóides mostrou uma atividade antiinflamatória pronunciada (52,1%), não inferior à droga quercetina comparada (50,9%) [ 184 ].
A atividade de supressão do câncer de extratos de pêssego e ameixa também foi avaliada [ 185]. Verificou-se que dentro de todas as frações, flavonóides e procianidinas foram mais potentes contra as três linhas celulares investigadas no estudo. A quercetina 3β-glicosídeo foi o composto mais bioativo identificado nas frações cromatográficas, capaz de exercer atividade antiproliferativa contra linhagens celulares de câncer de mama MDA-MB-435 e MCF-10A [ 185 ]. Efeitos inibitórios do crescimento também foram relatados nas linhagens celulares de câncer Caco-2, SW1116, HT29 e NCM460, a partir de extratos de ameixas e pêssegos notoriamente sendo enriquecidos com antocianinas [ 186]. A fração mais eficaz continha flavonóides em vez de antocianinas, sugerindo que uma atividade sinérgica com fenólicos em extratos de ameixa e pêssegos de frutos siberianos deveria explicar a ação em linhagens de células de câncer previamente observadas [ 186 ].
Muitas pesquisas recentes demonstraram que os fitoquímicos em frutas expressam uma panóplia orquestrada de ações semelhantes, muitas vezes mostrados como efeitos sobrepostos, que incluem a regulação da expressão de complexos enzimáticos antioxidantes desintoxicantes, ativação da imunidade inata, modulação da expressão gênica, replicação celular, autofagia e apoptose e atividade antimicrobiana [ 5 ]. Alguns exemplos são particularmente interessantes para o efeito da oxidação. O extrato de folhas de Prunus domestica é rico em ácidos hidroxicinâmicos e flavonóides. O extrato foi testado in vitro e mostrou a maior atividade contra a supressão da peroxidação lipídica. Verificou-se que o extrato reduziu o nível de produtos de peroxidação em 88,1% [ 187 ].
Um estudo prospectivo, envolvendo 9959 indivíduos (idade: 15-99 anos, sexo: igualmente distribuídos) e realizado na Finlândia, relatou uma interessante associação inversa entre a suposição de flavonóides com dietas e incidência de câncer [ 5 ].
Após um período de acompanhamento de 24 anos, os pesquisadores relataram que o risco de câncer de pulmão foi reduzido em 50% (quartil superior dos valores de ingestão de flavonóides). O consumo de quecetina contido nas maçãs e cebolas no Havaí foi inversamente correlacionado com a incidência de câncer de pulmão.
Além disso, o efeito da ingestão de cebola resultou particularmente promissor na redução da incidência de carcinoma espinocelular [ 5 ]. Os níveis plasmáticos crescentes de quercetina das cebolas ingeridas também foram associados a uma resistência aumentada à quebra da fita de DNA que ocorre nos linfócitos e a uma redução no nível de alguns catabólitos do estresse oxidativo nas amostras de urina [ 5 ].
Outros relatórios mostraram também que as antocianinas e cianidinas são capazes de reduzir as linhas celulares de cancro do cólon HT29 e HCT 116 [ 188 ]. Estes estudos relataram que os valores da concentração inibitória de 50% (IC 50 ) de antocianinas e cianidinas foram de 780 mM e 63 mM para células HT29 e 285 mM e 85 mM para células HCT116, respectivamente, sugerindo que antocianinas e cianidinas em cerejas podem ser promissoras como anticolon. compostos naturais de câncer [ 188 ]. Na verdade, as antocianidinas combatem muitos mecanismos biológicos, levando à agressividade do câncer, incluindo metástases e quimiorresistência [ 189 ].
A cianidina é um pigmento polifenólico que pode ser facilmente encontrado em muitas frutas vermelhas, incluindo amora, uva, framboesa, oxicoco, além de ameixas, maçãs e repolho vermelho e está presente também nas cebolas vermelhas. Tem um bom benefício potencial contra o câncer, graças à sua propriedade antioxidante [ 178 ]. Tem sido relatado que a cianidina atenua a proliferação celular no câncer e inibe a expressão gênica de COX-2 e iNOS em tumores de cólon [ 190 , 191 , 192 , 193].]. Um estudo mostrou que a cianidina-3-glicosídeo inibiu a ativação dos fatores de transcrição AP-1 e NF-κB induzida pelo benzo [a] pireno-7,8-diol-9,10-diol-epóxido, incluindo a fosforilação da MEK. MKK4, Akt e MAPKs [ 194 ]. Além disso, eles também bloquearam a ativação da via de sinalização da Fyn quinase, levando a um potencial quimiopreventivo [ 194 ]. Outros flavonóides, como cianidina-3-O-glicosídeo e cianidina-3-O-rutinosídeo, bem como os extratos etanólicos de framboesas, causaram a inibição do crescimento celular em linhas celulares de esôfago de ratos altamente tumorigênicas RE-149 DHD, mas não na linha celular tumorigênica mais fraca RE-149 [ 195 ]. Outros resultados mostraram que a cianidina inibe a luz ultravioleta B, COX-2induzida por UVB eExpressão de PGE2 em células epidérmicas suprimindo a atividade de NF-κB e AP-1 mediada por MAPK [ 195 ]. Além disso, a cianidina é capaz de atingir MKK-4 MEK-1 e Raf-1 na via de supressão da COX-2 induzida por UV [ 195 ]. Além disso, cianidina-3-galactosídeo e cianidina-3-glicosídeo são substratos para BRCP, enquanto cianidina, cianidina-3,5-diglucuronídeo e cianidina-3-rutinosídeo são inibidores de BRCP, embora seu efeito sobre a MDR1 seja fraco [ 178 , 196 ]. .
As catequinas do chá verde representam outra característica dos flavonóides anticancerígenos. O chá verde é uma bebida muito difundida e comumente usada no mundo. A maioria dos efeitos anticancerígenos do chá verde é atribuída ao EGCG [ 197 , 198 ]. O EGCG é capaz de matar células cancerígenas notoriamente resistentes a estímulos proapoptóticos e induz a morte através de uma via de necroptose em muitos cânceres [ 189 ].
Os polifenóis do chá podem prevenir o câncer modulando as aberrações epigenéticas que ocorrem na metilação do DNA, modificações das histonas e microRNAs. Ao alterar essas epimutações, elas regulam a dinâmica da cromatina e a expressão desses genes que induzem ou suprimem a formação de câncer [ 190 ].
Tanto as theaflavinas quanto as tearubiginas, que são compostos polifenólicos muito abundantes no chá preto, possuem um forte potencial antineoplásico. Polifenóis no chá preto inibem a proliferação celular e desencadeiam a apoptose em células de câncer de próstata Du 145 [ 191 ].
O uso de flavonóides a partir de frutas e vegetais crus deve ser incentivado com respeito a nutracutais de substâncias ativas purificadas [ 192 ]. Os efeitos dos flavonóides das plantas sobre o câncer podem ser até mesmo protetores em relação às linhas celulares de câncer; efeitos de vários polifenóis, como catequinas, quercetina, flavanonas, isoflavonas, ácido elágico, lignanas, polifenóis do vinho tinto, como resveratrol, e curcumina, em vários tipos de câncer, incluindo boca, estômago, duodeno, cólon, fígado, pulmão, glândula mamária e pele, foram observados [ 191 ]. Isso deve explicar a atividade bimodal mantida pelos flavonóides.
O flavonol quercetina geralmente atua como uma molécula anticâncer através de um processo que envolve a regulação negativa de alguns oncogenes (por exemplo, Mcl-1, Ras, MEK, P3K) ou também a regulação de alguns genes supressores de tumor, levando à erradicação do câncer [ 193].]. O kaempferol, que pode ser encontrado em vegetais como brócolis, chá, grapefruit, couve de Bruxelas, witchhazel e maçã, tem sido relatado como eficaz no câncer de pâncreas e pulmão [ 199 , 200 , 201 ]. Tem efeitos antiangiogênicos e sequestradores de radicais de oxigênio [ 178 , 202 , 203 , 204 ].
A flavona fisetina, presente em plantas, como morangos, caqui, maçãs, acácia greggii , acácia berlandieri , euroasiansmoketree, papagaio, cebola, pepino e uva, é um forte antioxidante, modulando as vias proteínicas quinase e lipídio quinase [ 205 ]. . Verificou-se que a fisetina exerce acções antitumorais nas linhas celulares de cancro do cólon HCT-116 [ 178 ]. Juntamente com outras flavonas e flavonóides como luteolina, galangina, quercetina e EGCG, a fisetina induz a expressão do fator Nrf2; além disso, induz o produto do gene da fase II HO-1em células epiteliais de pigmento da retina (RPE) humanas. Essas células podem proteger as células do EPR da morte induzida por estresse oxidativo, com alta eficácia e toxicidade insignificante [ 206 ]. Além disso, itlowered peróxido de hidrogénio (H 2 O 2 ) morte celular induzida por [ 189 , 207 ].
A isoflavona genisteína está presente em plantas, como tremoço, fava, soja, kudzu e psoralea, flemingiavestita e café. É um antioxidante e anti-helmíntico, além de exercer efeitos antioxidantes e ações antiangiogênicas (bloqueando a formação de novos vasos sanguíneos), além de bloquear a replicação celular e a sobrevivência [ 178 ].
A flavanona naringenina, comumente encontrada em frutas cítricas e laranjas, além de tomates e toranja, tem uma potente propriedade antioxidante [ 208 , 209 ]. Ele suprime as interações ligante-receptor de TGF-β [ 208 ] e a sinalização de TGF-β, controlando vários grupos de mecanismos celulares no câncer, incluindo proliferação celular, diferenciação e apoptose, bem como morin [ 189 , 208 , 210 ].
3. Conclusões e Observações Futuras
O uso de flavonóides e outros fitoquímicos na pesquisa sobre o câncer ainda é uma expectativa promissora, apesar dos muitos aspectos controversos em relação à escassez atual de resultados clínicos. Painéis nutricionais e diretrizes dietéticas devem encorajar e apoiar a introdução de fenólicos de plantas na composição diária das refeições, tentar reduzir a quantidade de nutracêuticos sintéticos e, ao invés disso, promover a ingestão de vegetais crus e frutas. A suplementação pode ser desejável se a fórmula da composição for a mais próxima possível da fonte bruta dos fitoquímicos suplementados, um item obrigatório que é muito difícil de alcançar com ótimos resultados. De qualquer forma, pesquisas sobre flavonóides e extratos vegetais garantem a atual farmacologia para encontrar e recuperar novos medicamentos, capaz de direcionar especificamente as células cancerígenas e atualizar nossa dotação terapêutica contra malignidades. As novidades muito recentes no campo da pesquisa do polifenol contra o câncer referem-se não apenas ao microRNA, mas também ao RNA não-codificante de longa duração, como a glicação da glicose na soja [211 ]. Novos insights fundamentais na biologia molecular dos fitoquímicos podem melhorar nossa capacidade de investigar e usar esses compostos contra o câncer.
Uma questão fundamental poderia ser: por que o uso de flavonóides é mais benéfico do que o uso de medicamentos quimiopreventivos contra o câncer? Como uma perspectiva futura, os flavonóides atuam como moléculas naturais, com surpreendentemente menos efeitos colaterais do que drogas quimiopreventivas. A capacidade de sintonizar sensivelmente mecanismos fundamentais na sobrevivência celular, autofagia e apoptose torna estes compostos particularmente úteis para serem adotados como pró-fármacos e também moléculas terapêuticas contra o câncer. A pesquisa clínica deve ser melhorada neste sentido, a fim de recuperar uma coleta de dados cada vez mais notável sobre a excelente capacidade dessas várias substâncias naturais para prevenir e combater tumores em humanos.
Financiamento
Esta pesquisa não recebeu financiamento externo.
Conflitos de interesse
Os autores declaram não haver conflitos de interesse.
Abreviaturas
| AAK | Quinase ativada por Akt |
| Akt | proteína quinase B |
| AMPK | proteinkinase ativada por adenosina-monofosfato |
| ESTÁ | elemento antioxidante-responsivo |
| ASK1 | cinase reguladora do sinal de apoptose 1 |
| Atg12 – Atg5 | fator de autofagia12 - fator de autofagia5 |
| Atg7 | fator de autofagia 7 |
| Bax | Proteína X associada a Bcl-2 |
| Bcl-2 | Linfoma de células B 2 (uma proteína antiapoptótica) |
| Lance | Domínio de interação com BH3 |
| BCRP | proteína de resistência ao câncer de mama |
| BNP3 | Bcl-2-adenovírusE1B 19 kDaproteína interativa com a proteína kDaproteína3 |
| 6-CEPN | 6-C- (E-feniletenil) naringenina |
| Cip1 | proteína 1 inibidora de ciclina (p21) |
| CYP | citocromo P450 |
| DAF16 | Factor associado a Dauer 16 |
| DAPK2 | proteína quinase associada à morte 2 |
| DRP1 | proteína relacionada à dinamina 1 |
| ERK | cinase regulada por sinal extracelular |
| FOXO | caixa de garfo O3 |
| HO-1 | heme oxigenase 1 |
| IKK | Quinase IkB |
| iNOS | sintase de óxido nítrico indutível |
| IRE-JNK-CHOP | elemento de resposta ao ferro - Janus quinase-ciclofosfamida-hidroxidaunorubicina-oncovin-prednisona) |
| JAK2 | Janus quinase 2 |
| JNK | Janus quinase |
| p38MAPK | p38 proteína quinase ativada por mitógeno |
| MEK | um sinônimo de MAPK |
| MDR1 | multirresistente 1 |
| Mfn2 | mitofusina-2 |
| mTOR | alvo de rapamicina em mamíferos |
| NB4 | uma linha celular de leucemia promielocítica aguda |
| NF-kB | fator nuclear kappa-light-enhancer da cadeia de células B ativadas |
| Nrf2 | fator nuclear fator 2 relacionado ao eritrócito 2 |
| PARP | polimerase de poli-ADP-ribose |
| PERK – ATF4 | proteína quinase RNA-like retículo endoplasmático quinase-ativando fator de transcrição 4 |
| PGC1α | coativador de receptor ativado por proliferador de peroxissomo gama 1-alfa |
| PGE2 | prostaglandina E2 |
| pEGFR | receptor do fator de crescimento epitelial fosforilado |
| PKA-PI3K | proteína quinase A-fosfoinositídeo 3 quinase |
| Raf1 | Fator associado a Ras 1 |
| SIR 2-1 | sirtuin 2-1 |
| SIRT1 | sirtuin 1 |
| Caracol / lesma | atores de transcrição em EMT |
| STAT3 | transdutor de sinal e ativador de transcrição 3 |
| TFAM | fator de transcrição A, mitocondrial |
| TRILHA | Ligante indutor de apoptose relacionado ao TNF |
| Wnt | sem asas / integrado |
Referências
- Chen, CY; Kao, CL; Liu, CM A Prevenção do Câncer, Anti-Inflamatória e Anti Oxidação de Fitoquímicos Bioativos visando a Via de Sinalização do TLR4. Int. J. Mol. Sci. 2018 , 19 , 2729. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chiou, YS; Li, S; Ho, CT; Pan, MH Prevenção do Câncer de Mama por Fitoquímicos Naturais: Focalizando Metas Moleculares e Estratégia Combinacional. Mol. Nutr. Food Res. 2018 , e1800392. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bonam, SR; Wu, YS; Tunki, L; Chellian, R .; Halmuthur, MSK; Muller, S .; Pandy, V. O que saiu de fitoterápicos e ervas comestíveis para o tratamento do câncer? Chem. Med. Chem. 2018 , 13 , 1854-1872. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Galati, G; O'Brien, PJ Potencial toxicidade dos flavonóides e outros fenólicos da dieta: Significado para suas propriedades quimiopreventivas e anticancerígenas. Radic Livre Biol. Med. 2004 , 37 , 287-303. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Liu, RH Benefícios para a saúde de frutas e vegetais são de combinações aditivas e sinérgicas de fitoquímicos. Sou. J. Clin. Nutr. 2003 , 78 (Supl. 3), S517-S520. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Sunan, W .; Meckling, K; Marcone, MF; Tasao, R. Alimentos ricos em antioxidantes fitoquímicos podem atuar como agentes anti-câncer? Food Res. Int. 2011 , 44 , 2545-2554. [ Google Scholar ]
- Yang, JH; Shin, BY; Han, JY; Kim, MG; Wi, JE; Kim, YW; Cho, IJ; Kim, SC; Shin, SM; Ki, SH Isorhamnetin protege contra o estresse oxidativo, ativando Nrf2 e induzindo a expressão de seus genes-alvo. Toxicol Appl. Pharmacol. 2014 , 274 , 293-301. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Aboonabi, A .; Singh, I. O papel quimiopreventivo das antocianinas na aterosclerose via ativação de Nrf2-ARE como indicador e modulador da redox. Biomed. Pharmacother. 2015 , 72 , 30-36. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Costa, LG; Garrick, JM; Roquè, PJ; Pellacani, C. Mecanismos de neuroproteção por quercetina: estresse oxidativo neutralizante e muito mais. Oxido Med. Célula. Longev. 2016 , 2016 , 2986796. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Tebay, LE; Robertson, H; Durant, ST; Vitale, SR; Penning, TM; Dinkova-Kostova, AT; Hayes, JD Mecanismos de ativação do fator de transcrição Nrf2 por estressores redox, dicas de nutrientes e estado de energia e as vias pelas quais ele atenua a doença degenerativa. Radic Livre Biol. Med. 2015 , 88 , 108-146. [ Google Scholar ] [ CrossRef ] [ versão verde ]
- Ighodaro, QM; Akinloye, QA Antioxidantes antioxidantes superóxido dismutase (SOD), catalase (CAT) e glutationa peroxidase (GPX): seu papel fundamental em toda a grade de defesa antioxidante Alexandria. J. Med. 2017 , no prelo. [ Google Scholar ] [ CrossRef ]
- Clere, N; Faure, S; Martinez, MC; Andriantsitohaina, R. Propriedades anticancerígenas dos flavonóides: Papéis em vários estágios da carcinogênese. Cardiovasc. Hematol Agentes Med. Chem. 2011 , 9 , 62-77. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Qiu, T; Wu, D; Yang, L; Ye, H; Wang, Q; Cao, Z; Tang, K. Explorando o Mecanismo dos Flavonóides Através da Análise Bioinformática Sistemática. Frente. Pharmacol. 2018 , 9 , 918. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Rauf, A .; Imran, M; Khan, IA; Ur-Rehman, M; Gilani, SA; Mehmood, Z; Mubarak, MS Potencial anticancerígeno da quercetina: uma revisão abrangente. Phytother. Res. 2018 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cook, MT Mecanismo de supressão de metástases por luteolina no câncer de mama. Câncer de Mama (Dove Med. Press) 2018 , 10 , 89-100. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Sak, K. Efeitos anticancerígenos específicos do sítio da quercetina flavonóide dietética. Nutr. Câncer 2014 , 66 , 177-193. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chirumbolo, S .; Bjørklund, G. PERM Hipótese: A maquinaria fundamental capaz de elucidar o papel dos Xenobióticos e da Hormese na Sobrevivência e Homeostase Celular. Int. J. Mol. Sci. 2017 , 18 , 165. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Sabharwal, SS; Schumacker, PT ROS mitocondrial em câncer: Iniciadores, amplificadores ou um calcanhar de Aquiles? Nat. Rev. Cancer 2014 , 14 , 709-721. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ralph, SJ; Rodríguez-Enríquez, S .; Neuzil, J.; Saavedra, E .; Moreno-Sánchez, R. As causas do câncer revisitadas: “malignidade mitocondrial” e transformação oncogênica induzida por ROS - Por que as mitocôndrias são alvos para a terapia do câncer. Mol. Asp. Med. 2010 , 31 , 145-170. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wallace, DC Mitocôndrias e câncer. Nat. Rev. Cancer 2012 , 12 , 685-698. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Bellot, GL; Liu, D .; Pervaiz, S. ROS, autofagia, mitocôndrias e câncer: Ras, o mestre oculto? Mitochondrion 2013 , 13 , 155–162. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Xiong, LG; Chen, YJ; Tong, JW; Gong, YS; Huang, JA; Liu, ZH A epigalocatequina-3-galato promove a expectativa de vida saudável através da mitohormesis durante o início da idade adulta em Caenorhabditis elegans. Redox Biol. 2018 , 14 , 305-315. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Steib, K; Schäffner, eu. Jagasia, R .; Ebert, B; Lie, DC As mitocôndrias modificam o desenvolvimento induzido pelo exercício de neurônios derivados de células-tronco no cérebro adulto. J. Neurosci. 2014 , 34 , 6624-6633. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Naik, PP; Birbrair, A .; Bhutia, SK Switch metabólico controlado por mitofagina reprograma o destino das células-tronco. Cell Mol. Life Sci. 2018 . [ Google Scholar ] [ CrossRef ] [ PubMed]
- Mitra, K. Fissão mitocondrial-fusão como um regulador chave emergente da proliferação e diferenciação celular. Bioessays 2013 , 35 , 955–964. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dal Yontem, F .; Kim, SH; Ding, Z; Grimm, E .; Ekmekcioglu, S .; Akcakaya, H. Alterações dinâmicas mitocondriais regulam a progressão celular do melanoma. J. Cell Biochem. 2018 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Huang, Y; Chen, K; Ren, Q; Yi, L; Zhu, J; Zhang, Q; Mi, M. Dihydromyricetin Atenua Atrofia Muscular Induzida por Dexametasona através da Melhoria da Função Mitocondrial através da via PGC-1α. Cell Physiol. Biochem. 2018 , 49 , 758-779. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lennon, FE; Salgia, R. Dinâmica mitocondrial: Biologia e terapia no câncer de pulmão. Expert Opin. Investig. Drugs 2014 , 23 , 675-692. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhao, J; Zhang, J; Yu, M; Xie, Y .; Huang, Y; Wolff, DW; Abel, PW; Tu, Y. Dinâmica mitocondrial regula migração e invasão de células de câncer de mama. Oncogene 2013 , 32 , 4814-4824. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Che, TF; Lin, CW; Wu, YY; Chen, YJ; Han, CL; Chang, YL; Wu, CT; Hsiao, TH; Hong, TM; Yang, PC A translocação mitocondrial do EGFR regula a dinâmica mitocondrial e promove a metástase no CPNPC. Oncotarget 2015 , 6 , 37349-37366. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- White, E. Mehnert, JM; Chan, CS Autofagia, Metabolismo e Câncer. Clin. Cancer Res. 2015 , 21 , 5037-5046. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Goldsmith, J .; Levine, B; Debnath, J. Autofagia e metabolismo do câncer. Métodos Enzymol. 2014 , 542 , 25-57. [ Google Scholar ] [ PubMed ]
- Poillet-Pérez, L; Despouy, G; Delage-Mourroux, R .; Boyer-Guittaut, M. Interação entre ROS e autofagia em células cancerosas, desde o início do tumor até a terapia do câncer. Redox Biol. 2015 , 4 , 184-192. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Hasima, N; Ozpolat, B. Regulação da autofagia por compostos polifenólicos como potencial estratégia terapêutica para o câncer. Morte Celular Dis. 2014 , 5 , e1509. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Radogna, F .; Dicato, M; Diederich, M. Crosstalk específico do tipo de câncer entre autofagia, necroptose e apoptose como um alvo farmacológico. Biochem. Pharmacol. 2015 , 94 , 1-11. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Khorsandi, L; Orazizadeh, M .; Niazvand, F .; Abbaspour, MR; Mansouri, E .; Khodadadi, A. Quercetina induz apoptose e necroptose em células de câncer de mama MCF-7. Bratisl Lek Listy 2017 , 118 , 123–128. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Lin, W .; Tongyi, S. O papel dos membros da família Bax / Bcl-2 no polifenol do chá verde induziu a necroptose de células Hep3B deficientes em p53. Tumor Biol. 2014 , 35 , 8065-8075. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- White, E. O papel da autofagia no câncer. J. Clin. Investig. 2015 , 125 , 42-46. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Brunelli, E .; Pinton, G; Bellini, P; Minassi, A .; Appendino, G; Moro, L. Autofagia induzida por flavonóides em células de câncer de mama sensíveis a hormônios. Fitoterapia 2009 , 80 , 327-332. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zheng, N; Liu, L; Liu, WW; Li, F .; Hayashi, T .; Tashiro, SI; Onodera, S .; Ikejima, T. Crosstalk de ROS / RNS e autofagia em apoptose induzida por silibinina de células de câncer de mama humano MCF-7 in vitro. Acta Pharmacol. Pecado. 2017 , 38 , 277-289. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Han, X; Liu, CF; Gao, N; Zhao, J; Xu, J. Kaempferol suprime a proliferação, mas aumenta a apoptose e a autofagia, regulando positivamente o microRNA-340 em células de câncer de pulmão humano. Biomed. Pharmacother. 2018 , 108 , 809-816. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhang, HW; Hu, JJ; Fu, RQ; Liu, X; Zhang, YH; Li, J; Liu, L; Li, YN; Deng, Q; Luo, QS; et al. Os flavonóides inibem a proliferação celular e induzem apoptose e autofagia através da regulação negativa da via de sinalização PI3K / AKT / mTOR / p70S6K / ULK mediada por PI3Ky em células de câncer de mama humano. Sci. Representação 2018 , 8 , 11255. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kania, E .; Pajk, B; Orzechowski, A. homeostase do cálcio e estresse ER no controle da autofagia em células cancerígenas. Biomed. Res. Int. 2015 , 2015 , 352794. [ Google Scholar] [ CrossRef ] [ PubMed ]
- Verfaillie, T .; Garg, AD; Agostinis, P. O direcionamento do estresse de ER induziu apoptose e inflamação no câncer. Cancer Lett. 2013 , 332 , 249-264. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Duluc, L; Soleti, R .; Clere, N; Andriantsitohaina, R .; Simard, G. Mitochondria como alvos potenciais de flavonóides: foco em adipócitos e células endoteliais. Curr. Med. Chem. 2012 , 19 , 4462-4474. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yang, J; Chen, W .; Zhang, B; Tian, F .; Zhou, Z; Liao, X; Li, C; Zhang, Y; Han, Y; Wang, Y .; et al. Lon na manutenção da homeostase do retículo mitocondrial e endoplasmático. Arco. Toxicol 2018 , 92 , 1913-1923. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Polo, M; Alegre, F .; Moragrega, AB; Gibellini, L; Marti-Rodrigo, A .; Blas-Garcia, A .; Esplugues, JV; Apostolova, N. Lon protease: Uma nova proteína matriz mitocondrial na interligação entre disfunção mitocondrial induzida por drogas e estresse do retículo endoplasmático. Fr. J. Pharmacol. 2017 , 174 , 4409-4429. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Hori, O .; Ichinoda, F .; Tamatani, T .; Yamaguchi, A .; Sentou-se em.; Ozawa, K; Kitao, Y .; Miyazaki, M; Harding, HP; Ron, D .; et al. Transmissão do estresse celular do retículo endoplasmático às mitocôndrias: Melhor expressão da protease Lon. J. Cell Biol. 2002 , 157 , 1151-1160. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Rainbolt, TK; Saunders, JM; Wiseman, RL Regulação da mitocôndria sensível ao estresse através da resposta da proteína ER desdobrada. Tendências Endocrinol. Metab. 2014 , 25 , 528-537. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ehren, JL; Maher, P. A regulação concomitante dos fatores de transcrição Nrf2 e ATF4 medeiam o aumento dos níveis de glutationa pela fisetina flavonóide. Biochem. Pharmacol. 2013 , 85 , 1816-1826. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, XM; Liu, J; Pan, FF; Shi, DD; Wen, ZG; Yang, PL A quercetina e a aconitina induz sinergicamente a apoptose de células HeLa do carcinoma cervical humano por meio da via de estresse do retículo endoplasmático (ER). PLoS One 2018 , 13 , e0191062. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Liu, CM; Ma, JQ; Sun, JM; Feng, ZJ; Cheng, C; Yang, W .; Jiang, H. Associação de alterações na via de sinalização mediada por estresse de ER com resistência à insulina induzida por chumbo e apoptose em ratos e sua prevenção por epigalocatequina-3-galato dimérico do tipo A. Food Chem. Toxicol 2017 , 110 , 325-332. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- García-Aguilar, A .; Cuezva, JM Uma revisão da inibição da ATP sintase mitocondrial por IF1 in vivo: Reprogramação de Mitohormesis induzindo metabolismo de energia. Frente. Physiol. 2018 , 9 , 1322. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bravo-Sagua, R .; Parra, V .; Ortiz-Sandoval, C; Navarro-Marquez, M .; Rodríguez, AE; Diaz-Valdivia, N; Sanhueza, C; Lopez-Crisosto, C; Tahbaz, N; Rothermel, BA; et al. A caveolina-1 prejudica a remodelação mediada pela PKA-DRP1 da comunicação ER-mitocôndria durante a fase inicial do estresse de ER. Morte Celular Diferente. 2018 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chang, CR; Blackstone, C. Drp1 fosforilação e regulação mitocondrial. EMBO Rep. 2007 , 8 , 1088-1089. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Cui, L; Li, Z; Chang, X; Cong, G; Hao, L. A quercetina atenua a calcificação vascular pela inibição do estresse oxidativo e da fissão mitocondrial. Vascul. Pharmacol. 2017 , 88 , 21-29. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ye, F .; Wang, H; Zhang, L; Zou, Y; Han, H; Huang, J. Baicalein induz a apoptose da linhagem celular de osteossarcoma humano MG-63 via expressão de BNIP3 induzida por ROS. Tumor Biol. 2015 , 36 , 4731-4740. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Herr, eu. Debatin, KM Resposta celular ao estresse e apoptose na terapia do câncer. Blood 2001 , 98 , 2603-2614. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Chircop, M; Speidel, D. Respostas de estresse celular em câncer e terapia de câncer. Frente. Oncol. 2014 , 4 , 304. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ozbey, U .; Attar, R .; Romero, MA; Alhewairini, SS; Afshar, B; Sabitaliyevich, UY; Hanna-Wakim, L; Ozcelik, B .; Farooqi, AA Apigenin como um produto natural anticancerígeno eficaz: destaque para as vias TRAIL, WNT / β-catenina, JAK-STAT e microRNAs. J. Cell Biochem. 2018 , no prelo. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Liao, Y .; Xu, Y; Cao, M; Huan, Y; Zhu, L; Jiang, Y; Shen, W .; Zhu, G. Luteolin induz a apoptose e autofagia em células ANA-1 de macrófagos de camundongos através da via Bcl-2. J. Immunol. Res. 2018 , 2018 , 4623919. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dong, X; Zhang, J; Yang, F; Wu, J; Cai, R .; Wang, T; Zhang, J. Efeito da luteolina no estado de metilação do gene OPCML e crescimento celular em células de câncer de mama. Exp. Ther. Med. 2018 , 16 , 3186-3194. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yumnam, S .; Raha, S; Kim, SM; Venkatarame Gowda Saralamma, V .; Lee, HJ; Ha, SE; Heo, JD; Lee, SJ; Kim, EH; Lee, WS; et al. Identificação de um novo biomarcador na morte celular induzida por tangerinina em células de câncer gástrico humano AGS. Oncol. Rep. 2018 , no prelo. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Surichan, S .; Arroo, RR; Tsatsakis, AM; Androutsopoulos, VP Tangeretin inibe a proliferação de células de câncer de mama humano através da indução da enzima CYP1A1 / CYP1B1 e do metabolismo mediado pela CYP1A1 / CYP1B1 ao produto 4 'hidroxi tangeretina. Toxicol In Vitro 2018 , 50 , 274-284. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Hirpara, KV; Aggarwal, P; Mukherjee, AJ; Joshi, N; Burman, AC Quercetina e seus derivados: síntese, usos farmacológicos com ênfase especial nas propriedades antitumorais e pró-fármacos com biodisponibilidade aumentada. Agentes Anticancerantes Chem. 2009 , 9 , 138-161. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kuo, WT; Tsai, YC; Wu, HC; Ho, YJ; Chen, YS; Yao, CH; Yao, CH Radiossensibilização do câncer de pulmão de não pequenas células por kaempferol. Oncol. Rep. 2015 , 34 , 2351–2356. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Choi, JB; Kim, JH; Lee, H; Pak, JN; Shim, BS; Kim, Espécies de Oxigênio Reativo SH e Ativação Mediada por p53 de p38 e Caspases estão Criticamente Envolvidas na Apoptose Induzida por Kaempferol em Células de Câncer Colorretal. J. Agric. Food Chem. 2018 , 66 , 9960-9967. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ye, C; Zhang, C; Huang, H; Yang, B; Xiao, G; Kong, D; Tian, Q; Song, Q; Song, Y .; Tan, H; et al. O composto natural Myricetin reprime eficazmente a progressão maligna do câncer de próstata, inibindo PIM1 e interrompendo a interação PIM1 / CXCR4. Cell Physiol. Biochem. 2018 , 48 , 1230-1244. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, J; Gong, X; Jiang, R .; Lin, D.; Zhou, T; Zhang, A .; Li, H; Zhang, X; Wan, J; Kuang, G; et al. Crescimento Inibido da Fisetina e Metástase do Cancro da Mama Tri-Negativo Invertendo a Transição Epitelial-a-Mesenquimatosa via Via Sinal PTEN / Akt / GSK3β. Frente. Pharmacol. 2018 , 9 , 772. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhu, Y .; Rao, Q; Zhang, X; Zhou, X. Galangin induziu efeitos antitumorais em células tumorais renais humanas mediadas por apoptose mediada por mitocôndrias, inibição da migração e invasão celular e direcionamento da via de sinalização PI3K / AKT / mTOR. J. BUON 2018 , 23 , 795-799. [ Google Scholar ] [ PubMed ]
- Wu, Q; Kroon, PA; Shao, H; Necessidades, PW; Yang, X. Efeitos Diferenciais da Quercetina e Dois dos Seus Derivados, Isorhamnetin e Isorhamnetin-3-glucuronide, na Inibição da Proliferação de Células MCF-7 do Cancro da Mama Humano. J. Agric. Food Chem. 2018 , 66, 7181-7189. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Elango, R .; Athinarayanan, J.; Subbarayan, VP; Lei, DKY; Alshatwi, AA Hesperetina induz uma via extrínseca desencadeada por apoptose e uma via independente de p53 em células H522 de câncer de pulmão humano. J. Asian Nat. Prod. Res. 2018 , 20 , 559-569. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- GumushanAktas, H .; Akgun, T. Naringenin inibe a metástase do câncer de próstata, bloqueando os canais de sódio dependentes de voltagem. Biomed. Pharmacother. 2018 , 106, 770-775. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Haque, MW; Bose, P; Siddique, MUM; Sunita, P; Lapenna, A .; Pattanayak, SP Taxifolin se liga com LXR (α & β) para atenuar a carcinogênese mamária induzida pelo DMBA através da via mTOR / Maf-1 / PTEN. Biomed. Pharmacother. 2018 , 105 , 27-36. [ Google Scholar ] [ PubMed ]
- Haque, MW; Pattanayak, SP Taxifolina inibe a carcinogênese da mama induzida por 7,12-dimetilbenz (a) antraceno regulando a via de sinalização AhR / CYP1A1. Pharmacogn. Mag. 2018 , 13 (Suppl. 4), S749-S755. [ Google Scholar ] [ PubMed ]
- Grube, S .; Ewald, C; Kögler, C; Lawson McLean, A .; Kalff, R .; Walter, J. Concentrações alcançáveis no Sistema Nervoso Central da Catequina do Chá Verde EGCG induzem estresse nas células de glioblastoma in vitro. Nutr. Câncer 2018 , 1-14. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Xiao, X; Jiang, K; Xu, Y; Peng, H; Wang, Z; Liu, S .; Zhang, G. (-) - Epigalocatequina-3-galato induz a apoptose celular na leucemia mielóide crônica, regulando as vias de sinalização p38-MAPK / JNK e JAK2 / STAT3 / AKT mediadas por Bcr / Abl. Clin. Exp. Pharmacol. Physiol. 2018 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Rawangkan, A .; Wongsirisin, P .; Namiki, K; Iida, K; Kobayashi, Y .; Shimizu, Y .; Fujiki, H .; Suganuma, M. Chá Verde A catequina é um inibidor de ponto de verificação imunológico alternativo que inibe a expressão de PD-L1 e o crescimento do tumor pulmonar. Moléculas 2018 , 23 , 2071. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Stadlbauer, S .; Steinborn, C; Klemd, A .; Hattori, F .; Ohmori, K; Suzuki, K; Huber, R .; Wolf, P .; Gründemann, C. Impacto do ECG da catequina do chá verde e seu análogo fluorado sintetizado em células cancerosas da próstata e células imunocompetentes estimuladas. Planta Med. 2018 , 84 , 813-819. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mukherjee, S .; Hussaini, R .; Mais branco.; Atwi, D .; Fried, A .; Sampat, S; Piao, L; Pan, Q; Banerjee, P. TriCurin, uma formulação sinérgica de curcumina, resveratrol e epicatequina galato, repolariza macrófagos associados a tumores e desencadeia uma resposta imune para causar a supressão de tumores HPV +. Cancer Immunol. Imunother 2018 , 67 , 761-774. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ma, X; O Ning, S. Cyanidin-3-glicosídeo atenua a angiogênese do câncer de mama via inibição da via STAT3 / VEGF. Phytother. Res. 2018 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chen, J; Zhu, Y .; Zhang, W .; Peng, X; Zhou, J; Li, F .; Han, B; Liu, X; Ou, Y; Yu, X. A delfinidina induziu autofagia protetora via supressão da via mTOR e ativação da via AMPK em células de câncer de mama HER-2 positivas. BMC Cancer 2018 , 18 , 342. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kang, HM; Park, BS; Kang, HK; Park, HR; Yu, SB; Kim, IR Delphinidin induz a apoptose e inibe a transição epitelial-mesenquimal através da via de sinalização ERK / p38 MAPK em linhas celulares de osteossarcoma humano. Environ Toxicol 2018 , 33 , 640-649. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Ma, CH; Zhang, YX; Tang, LH; Yang, XJ; Cui, WM; Han, CC; Ji, WY MicroRNA-1469, um microRNA responsivo a p53 promove a apoptose induzida por Genistein, tendo como alvo Mcl1 em células de câncer de laringe humana. Biomed. Pharmacother. 2018 , 106 , 665-671. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Venza, eu. Visalli, M; Oteri, R .; Beninati, C; Teti, D .; Venza, M. A genisteína reduz a proliferação de células de melanoma que expressam EP3 através da inibição da expressão de IL-8 induzida por PGE2. Int. Imunofarmacol. 2018 , 62 , 86-95. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dutta, B; Park, JE; Qing, ITY; Kon, OL; Sze, SK A Genisteína Fitoquímica Derivada da Soja Modifica a Topologia do Cromatoma para Restringir a Proliferação de Células Câncer. Proteômica 2018 , 18 , e1700474. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Liang, YS; Qi, WT; Guo, W .; Wang, CL; Hu, ZB; Li, AK Genisteína e daidzeína induzem a apoptose de células de câncer de cólon, inibindo o acúmulo de gotículas lipídicas. Alimento Nutr. Res. 2018 , 62 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Brusselmans, K; Vrolix, R .; Verhoeven, G; Swinnen, JV A indução da apoptose de células cancerígenas por flavonóides está associada à sua capacidade de inibir a atividade da sintase dos ácidos graxos. J. Biol. Chem. 2005 , 280 , 5636-5645. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhang, JS; Lei, JP; Wei, GQ; Chen, H; Ma, CY; Jiang, HZ inibidores da sintase de ácidos graxos naturais como potentes agentes terapêuticos para cânceres: uma revisão. Pharm. Biol. 2016 , 54 , 1919-1925. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bandyopadhyay, S .; Zhan, R; Wang, Y .; Pai, SK; Hirota, S; Hosobe, S .; Takano, Y; Saito, K; Furuta, E .; Iizumi, M; et al. Mecanismo de apoptose induzido pela inibição da sintase de ácidos graxos em células de câncer de mama. Cancer Res. 2006 , 66 , 5934-5940. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, B; Espinoza, I .; Liu, H; Lupu, R. A inibição da sintase dos ácidos graxos induz as espécies reativas de oxigênio (ROS) a inibir o crescimento de células cancerígenas de animais superexpressoras de HER2. Pesquisa sobre câncer. Em Anais da 98ª Reunião Anual da AACR de 2007, Los Angeles, CA, EUA, 14–18 de abril de 2007; Abst 4462. Associação Americana para Pesquisa do Câncer: Filadélfia, PA, EUA, 2007. [ Google Scholar ]
- Niki, E. Estresse oxidativo e antioxidantes: aflição ou eustress? Arch Biochem. Biofísica 2016, 595 , 19-24. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Murakami, A. Funcionalidade dependente da dose e toxicidade dos polifenóis do chá verde em roedores experimentais. Arco. Biochem. Biofísica 2014 , 557 , 3-10. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Desikan, R .; Hancock, J; Neill, S. Espécies de Oxigênio Reativo como Moléculas de Sinalização em “Antioxidantes de Espécies de Oxigênio Reativas em Plantas” ; Smirnoff, N., Ed .; Blackwell Publl: Oxford, UK, 2005; Capítulo 7; pp. 169–195. [ Google Scholar ]
- Kumari, S .; Badana, AK; GMM, GS; Malla, R. Espécies Reativas de Oxigênio: Um Constituinte Chave na Sobrevivência do Câncer. Biomark. Insights 2018 , 13 . [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Rubio, V .; García-Pérez, AI; Herráez, A .; Diez, JC Diferentes papéis de Nrf2 e NF-κB no desequilíbrio antioxidante produzido pela esculetina ou quercetina nas células da leucemia NB4. Chem. Biol. Interagir. 2018 , 294 , 158-166. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Khatami, M. Cancer; uma doença induzida do século XX! Indução de tolerância, aumento de entropia e 'Energia Negra': Perda de biorritmos (Anabolismo versus Catabolismo). Clin. Transl. Med. 2018 , 7 , 20. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Isono, M; Sato, A .; Asano, T; Okubo, K.; Asano, T. Avaliação do Potencial Terapêutico do Fenoxodiol, um Novo Analog de Isoflavona, em Células Renais de Câncer. Anticancer Res. 2018 , 38 , 5709-5716. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chien, KJ; Yang, ML; Tsai, PK; Tal; Chen, CH; Horng, CT; Yeh, CH; Chen, WY; Lin, ML; Chen, CJ; et al. Citotoxicidade induzida por safrol, dano ao DNA e apoptose em macrófagos via geração de espécies reativas de oxigênio e fosforilação de Akt. Environ Toxicol Pharmacol. 2018 , 64 , 94-100. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Im, E .; Yeo, C; Lee, EO A luteolina induz a apoptose dependente de caspase via inibição da via AKT / osteopontin em células SK-Hep-1 de carcinoma hepatocelular humano. Life Sci. 2018 , 209 , 259-266. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gu, ZF; Zhang, ZT; Wang, JY; Xu, BB Icariin exerce efeitos inibitórios sobre o crescimento e metástase de células do carcinoma esofágico KYSE70 via PI3K / AKT e STAT3. Environ Toxicol Pharmacol. 2017 , 54 , 7–13. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yu, M; Qi, B; Xiaoxiang, W .; Xu, J; Liu, X. Baicalein aumenta a sensibilidade à cisplatina de células de adenocarcinoma de pulmão A549 através da via PI3K / Akt / NF-kB. Biomed. Pharmacother. 2017 , 90 , 677–685. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhou, H; Li, XM; Meinkoth, J; Pittman, RN Akt regula a sobrevivência celular e a apoptose em um nível pós-mitocondrial. J. Cell Biol. 2000 , 151 , 483-494. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ahn, J; Won, M; Choi, JH; Kim, YS; Jung, CR; Im, DS; Kyun, ML; Alho-poró.; Song, KB; Chung, KS Ativação mediada por espécies reativas de oxigênio da cascata de sinalização Akt / ASK1 / p38 e regulação negativa de p21 (Cip1) são necessárias para a apoptose induzida por shikonin. Apoptosis 2013 , 18 , 870-881. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Pan, J; Chang, Q; Wang, X; Filho, Y; Zhang, Z; Chen, G; Luo, J; Bi, Y; Chen, F .; Shi, X. Via de sinalização Akt / ASK1 / p38 ativada por espécies reativas de oxigênio na apoptose induzida pelo composto de níquel em células BEAS 2B. Chem. Res. Toxicol 2010 , 23 , 568-577. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Puckett, MC; Goldman, EH; Cockrell, LM; Huang, B; Kasinski, AL; Du, Y; Wang, CY; Lin, A .; Ichijo, H .; Khuri, F .; et al. Integração da sinalização de estresse mediada por quinase 1 reguladora de sinal de apoptose com a cascata Akt / proteína cinase B-IkB quinase. Mol. Cell Biol. 2013 , 33 , 2252-2259. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kaltschmidt, B; Greiner, JFW; Kadhim, HM; Kaltschmidt, C. Papel Específico da Subunidade do NF-κB no Câncer. Biomedicamentos 2018 , 6 , 44. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ashraf, AHMZ; Afroze, SH; Yamauchi, K; Zawieja, DC; Keuhl, TJ; Erlandson, LW; Uddin, MN Mecanismo Diferencial de Ação de 3,4 ′, 7- O- trimetilquercetina em Três Tipos de Células de Câncer de Ovário. Anticancer Res. 2018 , 38 , 5131-5137. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Valko, M; Rhodes, CJ; Moncol, J.; Izakovic, M; Mazur, M. Radicais livres, metais e antioxidantes no câncer induzido pelo estresse oxidativo. Chem. Biol. Interagir. 2006 , 160 , 1-40. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chen, CT; Chen, YT; Hsieh, YH; Weng, CJ; Yeh, JC; Yang, SF; Lin, CW; Yang, JS A glabridina induz apoptose e parada do ciclo celular em células de câncer bucal através da via de sinalização JNK1 / 2. Environ Toxicol 2018 , 33 , 679-685. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhang, W .; Zhang, Y; Ding, K; Zhang, H; Zhao, Q; Liu, Z; Xu, Y. Envolvimento de JNK1 / 2-NF-κBp65 na regulação de HMGB2 na apoptose induzida por isquemia / reperfusão miocárdica em cardiomiócitos AC16 humanos. Biomed. Pharmacother. 2018 , 106 , 1063-1071. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cincin, ZB; Kiran, B; Baran, Y .; Cakmakoglu, B. Hesperidin promove a morte celular programada pela regulação negativa da via de sinalização do receptor de estrógeno não-genômico em células cancerosas endometriais. Biomed. Pharmacother. 2018 , 103 , 336-345. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yang, J; Foto.; Wang, G. Inibição da via PI3K / Akt / mTOR pela apigenina induz apoptose e autofagia em células de carcinoma hepatocelular. Biomed. Pharmacother. 2018 , 103 , 699-707. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Celińska-Janowicz, K .; Zarêba, I .; Lazarek, U .; Teul, J; Tomczyk, M; Pałka, J; Miltyk, W. Constituintes de própolis: Chrysin, ácido cafeico, ácido p-cumárico e ácido ferúlico induzem apoptose dependente de PRODH / POX em células de carcinoma de células escamosas de língua humana (CAL-27). Frente. Pharmacol. 2018 , 9 , 336. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gaman, L; Dragos, D .; Vlad, A .; Robu, GC; Radoi, MP; Stroica, L; Badea, M; Gilca, M. Fitocêuticos na pancreatite aguda: visando o equilíbrio entre apoptose e necrose. Evid. Complemento Baseado. Altern. Med. 2018 , 2018 , 5264592. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yeung, AWK; El-Demerdash, A .; Berindan-Neagoe, I; Atanasov, AG; Ho, YS Respostas Moleculares de Cânceres por Produtos Naturais: Modificações da Autofagia Revelada pela Análise de Literatura. Crit. Rev. Oncog. 2018 , 23 , 347-370. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhang, C; Hao, Y .; Wu, L; Dong, X; Jiang, N; Cong, B; Liu, J; Zhang, W .; Tang, D; De Perrot, M; et al. A curcumina induz a apoptose e inibe a angiogênese no mesotelioma maligno murino. Int. J. Oncol. 2018 , no prelo. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chung, SS; Dutta, P; Austin, D; Wang, P; Awad, A .; Vadgama, JV Combinação de resveratrol e 5-flurouracil aumentou a atividade anti-telomerase e a apoptose inibindo as vias de sinalização STAT3 e Akt em células humanas de câncer colorretal. Oncotarget 2018 , 9 , 32943–32957. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wang, Y .; Zhou, P; Qin, S .; Xu, D; Liu, Y .; Fu, W .; Ruan, B; Zhang, L; Zhang, Y; Wang, X; et al. Os análogos de 2-piridilciclohexanona de análogos de curcumina induzem apoptose via inibição da via JAK2-STAT3 em células de carcinoma de células escamosas esofágicas humanas. Frente. Pharmacol. 2018 , 9 , 820. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Baek, SH; Ko, JH; Lee, H; Jung, J; Kong, M; Lee, JW; Lee, J; Chinnathambi, A .; Zayed, ME; Alharbi, SA; et al. O resveratrol inibe a via de sinalização de STAT3 através da indução de SOCS-1: Função na radiossensibilização por indução de apoptose em células tumorais do pescoço da cabeça. Phytomedicine 2016 , 23 , 566-577. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Masuelli, L; Benvenuto, M; Di Stefano, E .; Mattera, R .; Fantini, M; De Feudis, G; De Smaele, E .; Tresoldi, eu. Giganti, MG; Modesti, A .; et al. A curcumina bloqueia a autofagia e ativa a apoptose de linhagens de mesotelioma maligno e aumenta a sobrevida de camundongos intraperitonealmente transplantados com uma linhagem de mesotelioma maligno. Oncotarget 2017 , 8 , 34405-34422. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wu, XP; Xiong, M; Xu, CS; Duan, LN; Dong, YQ; Luo, Y .; Niu, TH; Resveratrol induz a apoptose de células leucêmicas mielógenas crônicas humanas in vitro através da fosforilação de H2AX regulada por p38 e JNK. Acta Pharmacol. Pecado. 2015 , 36 , 353-361. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Zheng, R .; Deng, Q; Liu, Y .; Zhao, P. A curcumina inibe o crescimento celular de carcinoma gástrico e induz a apoptose suprimindo a via de sinalização Wnt / β-catenina. Med. Sci. Monit. 2017 , 23 , 163-171. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zou, Y; Yang, J; Jiang, D. O resveratrol inibe a sinalização Wnt canônica em células humanas de osteossarcoma MG-63. Mol. Med. Rep. 2015 , 12 , 7221–7226. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Divya, CS; Pillai, MR A ação antitumoral da curcumina nas células associadas ao papilomavírus humano envolve a regulação negativa dos oncogenes virais, a prevenção da translocação de NFkB e AP-1 e a modulação da apoptose. Mol. Carcinog. 2006 , 45 , 320-332. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Elshaer, M; Chen, Y; Wang, XJ; Tang, X. Resveratrol: Uma visão geral de seus mecanismos anti-câncer. Life Sci. 2018 , 207 , 340-349. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Shirley, S .; Micheau, O. Targeting c-FLIP no câncer. Cancer Lett. 2013 , 332 , 141-150. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wright, C; Iyer, AKV; Yakisich, JS; Azad, N. Efeitos anti-tumorigênicos do resveratrol em células de câncer de pulmão através da modulação de c-FLIP. Curr. Cancer Drug Targets 2017 , 17 , 669–680. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chin, HK; Horng, CT; Liu, YS; Lu, CC; Su, CY; Chen, PS; Chiu, HY; Tsai, FJ; Shieh, PC; Yang, JS O Kaempferol inibe a capacidade angiogênica direcionando o receptor VEGF-2 e regula negativamente as vias PI3K / AKT, MEK e ERK em células endoteliais de veia umbilical humana estimuladas por VEGF. Oncol. Rep. 2018 , 39 , 2351–2357. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Semaan, J; Pinon, A .; Rioux, B; Hassan, L; Limami, Y .; Pouget, C; Fagnère, C; Sol, V; Diab-Assaf, M; Simon, A .; et al. Resistência à Apoptose Induzida por 3-HTMC Através da Ativação das vias PI3K / Akt, MEK / ERK e p38 / COX-2 / PGE (2) em Células de Cancro Colorrectal Humano HT-29 e HCT116. J. Cell Biochem. 2016 , 117 , 2875-2885. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wani, ZA; Guru, SK; Rao, AV; Sharma, S .; Mahajan, G .; Behl, A .; Kumar, A .; Sharma, PR; Kamal, A .; Bhushan, S .; et al. Um novo derivado de chalcona de quinazolinona induz a apoptose dependente de mitocôndria e inibe a via de sinalização PI3K / Akt / mTOR em células humanas de câncer de cólon HCT-116. Food Chem. Toxicol 2016 , 87 , 1-11. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Ren, KW; Li, YH; Wu, G; Ren, JZ; Lu, HB; Li, ZM; Nanopartículas de quercetina exibem atividade antitumoral via inibição da proliferação e indução de apoptose em células de câncer de fígado. Int. J. Oncol. 2017 , 50 , 1299–1311. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Xu, Y; Gao, CC; Pan, ZG; Zhou, CW Irigenin sensibiliza a apoptose induzida por TRAIL através do aumento de moléculas pró-apoptóticas em células de câncer gástrico. Biochem. Biofísica Res. Comum. 2018 , 496 , 998-1005. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Jaudan, A .; Sharma, S .; Malek, SNA; Dixit, A. Indução da apoptose pela pinostrobina em células humanas do câncer do colo do útero: Possível mecanismo de ação. PLoS One 2018 , 13 , e0191523. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kang, CH; Molagoda, IMN; Choi, YH; Park, C; Lua, DO; Kim, GY Apigenina promove a apoptose mediada por TRAIL, independentemente da geração de ROS. Food Chem. Toxicol 2018 , 111 , 623-630. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhao, Y .; Tian, B; Wang, Y .; Ding, H. Kaempferol Sensibiliza Células de Câncer de Ovário Humano-OVCAR-3 e SKOV-3 para Apoptose Induzida por Apoptose Relacionada ao Fator de Necrose Tumoral (TRAIL) por Via JNK / ERK-CHOP e Regulação Positiva de Receptores de Morte 4 e 5. Med. Sci. Monit. 2017 , 23 , 5096-5105. [ Google Scholar ] [ CrossRef ] [ PubMed] [ versão verde ]
- Kim, TW; Lee, SY; Kim, M; Cheon, C; Ko, SG Kaempferol induz morte celular autofágica via IRE1-JNK-CHOP e inibição de G9a em células de câncer gástrico. Morte Celular Dis. 2018 , 9, 875. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gump, JM; Thorburn, A. Autofagia e apoptose: Qual é a conexão? Trends Cell Biol. 2011 , 21, 387-392. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Noguchi, M; Hirata, N; Suizu, F. As ligações entre AKT e duas cascatas proteolíticas intracelulares: ubiquitinação e autofagia. Biochim. Biofísica Acta 2014 , 1846 , 342-352. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Xie, LL; Shi, F .; Tan, Z; Li, Y; Bode, AM; Cao, Y. Homeostase da estrutura da rede mitocondrial e morte celular. Cancer Sci. 2018 , no prelo. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Fan, YJ; Zong, WX A decisão celular entre apoptose e autofagia. Queixo. J. Cancer 2013 , 32, 121-129. [ Google Scholar ] [ PubMed ]
- Gordy, C; Ele, YW O crosstalk entre autofagia e apoptose: Onde isso leva? Protein Cell 2012 , 3 , 17-27. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Thorburn, A. Apoptosis e autophagy: Conexões regulatórias entre dois processos supostamente diferentes. Apoptosis 2008 , 13 , 1-9. [ Google Scholar ] [ CrossRef ] [ PubMed]
- Zhou, F .; Yang, Y; Xing, D. Bcl-2 e Bcl-xL desempenham papéis importantes no crosstalk entre autofagia e apoptose. FEBS J. 2011 , 278 , 403-413. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yang, J; Yao, S. JNK-Bcl-2 / Bcl-xL-Bax / Bak Pathway Media o Crosstalk entre Autofagia Induzida por Matrine e Apoptose via Interplay com Beclin 1. Int. J. Mol. Sci. 2015 , 16 , 25744-25758. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Webster, BR; Scott, eu. Traba, J; Han, K; Sack, MN Regulação de autofagia e mitofagia por disponibilidade de nutrientes e acetilação. Biochim. Biofísica Acta 2014 , 1841 , 525-534. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Hosp, F .; Lassowskat, eu. Santoro, V .; De Vleesschauwer, D .; Fliegner, D .; Redestig, H; Mann, M; Christian, S .; Hannah, MA; Finkemeier, I. Acetilação de lisina nas mitocôndrias: do inventário à função. Mitochondrion 2017 , 33 , 58–71. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Jiang, K; Wang, W .; Jin, X; Wang, Z; Ji, Z; Meng, G. Silibinin, um flavonóide natural, induz a autofagia por disfunção mitocondrial dependente de ERO e perda de ATP envolvendo o BNIP3 em células de câncer de mama MCF7 humanas. Oncol. Rep. 2015 , 33 , 2711–2718. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Levy, JMM; Torres, CG; Thorburn, A. Alvejando autophagy em câncer. Nat. Rev. Cancer 2017, 17 , 528-542. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kaczanowski, S. Apoptosis: sua origem, história, manutenção e as implicações médicas para o câncer e envelhecimento. Phys. Biol. 2016 , 13 , 031001. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Guo, JY; Chen, HY; Mathew, R .; Fan, J; Strohecker, AM; Karsli-Uzunbas, G .; Kamphorst, JJ; Chen, G; Lemons, JM; Karantza, V .; et al. O Ras ativado requer autofagia para manter o metabolismo oxidativo e a tumorigênese. Genes Dev. 2011 , 25 , 460-470. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Guo, JY; Xia, B; White, E. Promoção do tumor mediada por autofagia. Cell 2013 , 155 , 1216-1219. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhao, Y .; Fan, D; Ru, B; Cheng, KW; Hu, S; Zhang, J; Li, ET; Wang, M. 6-C- (E-feniletenil) naringenina induz a inibição do crescimento celular e autofagia citoprotetora em células de câncer de cólon. EUR. J. Cancer 2016 , 68 , 38-50. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yuan, L; Nos estamos.; Wang, J; Liu, X. A issoorientina induz a apoptose e a autofagia simultaneamente por vias de sinalização p53 relacionadas a espécies reativas de oxigênio (ROS), PI3K / Akt, JNK e p38 em células cancerígenas HepG2. J. Agric. Food Chem. 2014 , 62 , 5390-5400. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhang, L; Wang, H; Cong, Z; Xu, J; Zhu, J; Ji, X; Ding, K. Wogonoside induz a apoptose relacionada à autofagia em células de glioblastoma humano. Oncol. Rep. 2014 , 32 , 1179-1187. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yi, HS; Chang, JY; Shong, M. A resposta proteica desdobrada mitocondrial e mitohormesis: Uma perspectiva sobre doenças metabólicas. J. Mol. Endocrinol. 2018 , 61 , R91-R105. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Xue, J; Li, R .; Zhao, X; Mac.; Lv, X; Liu, L; Liu, P. Morusin induz morte celular semelhante à paraptose através de sobrecarga de cálcio mitocondrial e disfunção no câncer de ovário epitelial. Chem. Biol. Interagir. 2018 , 283 , 59-74. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lee, D; Kim, IY; Saha, S; Choi, KS Paraptosis no arsenal anti-câncer de produtos naturais. Pharmacol. Ther. 2016 , 162 , 120-133. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Misturar.; Wang, C; Sun, C; Chen, X; Huo, X; Zhang, Y; Li, G; Xu, B; Zhang, J; Xie, J; et al. O Xanthohumol induz a paraptose de células de leucemia através da via de sinalização da proteína cinase ativada por mitógeno p38. Oncotarget 2017 , 8 , 31297–31304. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yumnam, S .; Hong, GE; Raha, S; Saralamma, VV; Lee, HJ; Lee, WS; Kim, EH; Kim, Disfunção Mitocondrial GS e Sobrecarga de Ca (2+) Contribui para a Paraptose Induzida por Hesperidina em Células de Hepatoblastoma, HepG2. J. Cell Physiol. 2016 , 231 , 1261-1268. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lalaoui, N; Lindqvist, LM; Sandow, JJ; Ekert, PG As relações moleculares entre apoptose, autofagia e necroptose. Semin. Cell Dev. Biol. 2015 , 39 , 63-69. [ Google Scholar ] [ CrossRef] [ PubMed ]
- Coleman, V .; Sa-Nguanmoo, P .; Koenig, J; Schulz, TJ; Grune, T; Klaus, S .; Kipp, AP; Ost, M. Envolvimento parcial de Nrf2 na mitohormese do músculo esquelético como uma resposta adaptativa ao desacoplamento mitocondrial. Sci. Rep. 2018 , 8 , 2446. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Cox, CS; McKay, SE; Holmbeck, MA; Christian, BE; Scortea, AC; Tsay, AJ; Newman, LE; Shadel, GS Mitohormesis em camundongos via ativação basal sustentada da sinalização mitocondrial e antioxidante. Cell Metab. 2018 , 28 , 776-786. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yong, CQY; Tang, BL Um Mensageiro Codificado Mitocondrial no Núcleo. Células 2018 , 7 , 105. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dandawate, PR; Subramaniam, D .; Jensen, RA; Anant, S. Direcionamento de células-tronco cancerosas e vias de sinalização por fitoquímicos: Nova abordagem para a terapia do câncer de mama. Semin. Câncer Biol. 2016 , 40–41 , 192–208. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Liu, F .; Zhang, S .; Yin, M; Guo, L; Xu, M; Wang, Y. Nobiletin inibe a transição epitelial-mesenquimal induzida por hipóxia em células de carcinoma de células renais. J. Cell Biochem. 2018 , no prelo. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wang, N; Zhou, F .; Guo, J; Zhu, H; Luo, S .; Cao, J. Euxanthone suprime o crescimento do tumor e metástase no câncer colorretal via segmentação da via CIP2A / PP2A. Life Sci. 2018, 209 , 498-506. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Chang, JH; Cheng, CW; Yang, YC; Chen, WS; Hung, WY; Chow, JM; Chen, PS; Hsiao, M; Lee, WJ; Chien, MH Down Regulating CD26 / DPPIV por apigenina modula a interação entre Akt e Snail / Slug sinalizando para conter a metástase do câncer de pulmão com múltiplos status de EGFR. J. Exp. Clin. Cancer Res. 2018 , 37 , 199. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Shrivastava, S .; Jeengar, MK; Thummuri, D .; Koval, A .; Katanaev, VL; Marepally, S .; Naidu, VGM A cardamonina, uma chalcona, inibe a invasividade de células de câncer de mama triplo-negativo humano pela regulação negativa das cascatas de sinalização Wnt / β-catenina e pela reversão da transição epitelial-mesenquimal. Biofactors 2017 , 43 , 152–169. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dogan Turacli, eu. Demirtas Korkmaz, F .; Candar, T; Ekmekci, efeitos de A. Flavopiridol na metástase em células de adenocarcinoma de pulmão mutante KRAS. J. Cell Biochem. 2018 , no prelo. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cichon, MA; Radisky, DC A transição epitelial-mesenquimal induzida por ROS em células epiteliais mamárias é mediada pela ativação dependente de NF-kB de Snail. Oncotarget 2014, 5 , 2827-2838. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Fukawa, T; Kajiya, H .; Ozeki, S .; Ikebe, T; Okabe, K. Espécies reativas de oxigênio estimulam a transição mesenquimal epitelial em queratinócitos epidérmicos humanos normais via secreção de TGF-beta. Exp. Cell Res. 2012 , 318 , 1926-1932. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Jiang, J; Wang, K; Chen, Y; Chen, H; Nice, CE; Huang, C. Regulação redox na transição epitelial-mesenquimal de células tumorais: Bases moleculares e estratégia terapêutica. Sinal. Transduto Alvo Ther. 2017 , 2 , 17036. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, W .; Cao, L; Han, L; Xu, Q; Ma, Q. A superóxido dismutase promove a transição epitelial-mesenquimal das células cancerosas pancreáticas via ativação do eixo H 2 O 2 / ERK / NF-κB. Int. J. Oncol. 2015 , 46 , 2613-2620. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Guerra, F .; Guaragnella, N; Arbini, AA; Bucci, C; Giannattasio, S .; Moro, L. Disfunção Mitocondrial: Um Potencial Novel de Transição Epitelial-a-Mesenquimal no Câncer. Frente. Oncol. 2017 , 7 , 295. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gugnoni, M; Sancisi, V .; Manzotti, G; Gandolfi, G; Ciarrocchi, A. Autofagia e transição epitelial-mesenquimal: uma interação intricada no câncer. Morte Celular Dis. 2016 , 7 , e2520. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Zhang, X; Cheng, Q; Yin, H; Yang, G. Regulação de autofagia e EMT pela interação entre p53 e RAS durante a progressão do câncer (Revisão). Int. J. Oncol. 2017 , 51 , 18–24. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Wang, H; Khor, TO; Shu, L; Su, ZY; Fuentes, F .; Lee, JH; Kong, AN Plants vs. Cancer: Uma revisão sobre os fitoquímicos naturais na prevenção e tratamento de cânceres e sua capacidade de drogar. Agentes Anticancerantes Chem. 2012 , 12 , 1281–1305. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Block, G; Patterson, B; Subar, A. Frutas, vegetais e prevenção do câncer: Uma revisão das evidências epidemiológicas. Nutr. Câncer 1992 , 18 , 1-29. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mollakhalili Meybodi, N; Mohammad Mortazavian, A .; Bahadori Monfared, A .; Sohrabvandi, S .; Aghaei Meybodi, F. Fitoquímicos na Prevenção do Câncer: Uma Revisão da Evidência. Irã. J. Cancer Prev. 2017 , 10 , e7219. [ Google Scholar ] [ CrossRef ]
- Pasko, P .; Makowska-Was, J; Chlopicka, J; Szlosarczyk, M; Tyszka-Czochara, M; Dobrowolska-Iwanek, J; Agnieszka Galanty, A. Frutos Siberianos do Sul: Seus constituintes químicos selecionados, atividade biológica e uso tradicional na medicina popular e nutrição diária. J. Med. Plantas Res. 2012 , 6 , 4698-4706. [ Google Scholar ] [ CrossRef ]
- Mulabagal, V; Lang, GA; DeWitt, DL; Dalavoy, SS; Nair, MG Conteúdo de antocianinas, peroxidação lipídica e atividade inibitória da enzima ciclooxigenase de cerejas doces e azedas. J. Agric. Food Chem. 2009 , 57 , 1239–1246. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bobe, G; Wang, B; Seeram, NP; Nair, MG; Bourquin, LD Extrato de cereja ácido rico em antocianina dietético inibe a tumorigênese intestinal em camundongos APC (Min) com níveis sub-ótimos de sulindaco. J. Agric. Food Chem. 2006 , 54 , 9322-9328. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Voronina, LM; Kravchenko, GB; Zagaiko, AL; Upyr, LV; Popovich, VP O estudo do efeito de alguns extratos vegetais sobre a fase exsudativa da inflamação induzida pela introdução de diferentes flogogenes. Notícias Pharm. 2010 , 1 , 66-68. [ Google Scholar ]
- Noratto, G .; Porter, W .; Byrne, D .; Cisneros-Zevallos, L. Identificação de polifenóis de pessegueiro e ameixa com potencial quimiopreventivo contra células de câncer independentes de estrogênio. J. Agric. Food Chem. 2009 , 57 , 5219-5226. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lea, MA; Ibeh, C; des Bordes, C; Vizzotto, M; Cisneros-Zevallos, L; Byrne, DH; Okie, WR; Moyer, MP Inibição do crescimento e indução da diferenciação de células de câncer de cólon por compostos fenólicos de pêssego e ameixa. Anticancer Res. 2008 , 28 , 2067-2076. [ Google Scholar ] [ PubMed ]
- Zagayko, AL; Senyuk, IV; Lenchyk, LV; Galimullin, RM Estudo da atividade antioxidante do extrato de folhas de ameixa comum. Ukr. Biofarma J. 2014 , 1 , 25-28. [ Google Scholar ]
- Kang, SY; Seeram, NP; Nair, MG; Bourquin, LD Antocianinas de cereja Tart inibem o desenvolvimento do tumor em camundongos Apc (Min) e reduzem a proliferação de células de câncer de cólon humano. Cancer Lett. 2003 , 194 , 13-19. [ Google Scholar ] [ CrossRef ]
- Lefranc, F .; Tabanca, N; Kiss, R. Avaliar os efeitos anticancerígenos associados a produtos alimentícios e / ou nutracêuticos usando testes farmacológicos pré-clínicos in vitro e in vivo. Semin. Câncer Biol. 2017 , 46 , 14-32. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Bag, A .; Saco, Polifenóis do N. Tea e Prevenção de Aberrações Epigenéticas no Câncer. J. Nat. Sci. Biol. Med. 2018 , 9 , 2-5. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Pandey, KB; Rizvi, SI Polifenóis vegetais como antioxidantes dietéticos na saúde e na doença humana. Oxido Med. Longev celular. 2009 , 2 , 270-278. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Busch, C; Burkard, M; Leischner, C; Lauer, UM; Frank, J .; Venturelli, S. Atividades epigenéticas de flavonóides na prevenção e tratamento do câncer. Clin. Epigenet. 2015 , 7 , 64. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Russo, M; Spagnuolo, C; Tedesco, eu. Bilotto, S .; Russo, GL O flavonóide quercetina na prevenção de doenças e terapia: Fatos e fantasias. Biochem. Pharmacol. 2012 , 83 , 6–15. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lim, TG; Kwon, JY; Kim, J; Song, NR; Lee, KM; Heo, YS; Lee, HJ; Lee, KW O cianidin-3-glucosídeo suprime a expressão da ciclooxigenase-2 induzida pela B [a] PDE ao inibir diretamente a atividade da cinase de Fyn. Biochem. Pharmacol. 2011 , 82 , 167-174. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Kim, JE; Kwon, JY; Seo, SK; Filho, JE; Jung, SK; Min, SY; Hwang, MK; Heo, YS; Lee, KW; Lee, HJ A cianidina suprime a expressão de COX-2 induzida por ultravioleta B em células epidérmicas, tendo como alvo MKK4, MEK1 e Raf-1. Biochem. Pharmacol. 2010 , 79 , 1473-1482. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Dreiseitel, A .; Oosterhuis, B; Vukman, KV; Schreier, P; Oehme, A .; Locher, S .; Hajak, G; Antocianinas de areia, PG Berry e antocianidinas apresentam distintas afinidades para os transportadores de efluxo BCRP e MDR1. Fr. J. Pharmacol. 2009 , 158 , 1942-1950. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Ullah, N; Ahmad, M; Aslam, H; Tahir, MA; Aftab, M; Bibi, N; Ahmad, S. Phytocompounds chá verde como anticancerígeno: uma revisão. Pac Asiático J. Trop. Dis. 2016 , 6 , 330–336. [ Google Scholar ] [ CrossRef ]
- Moreno, FS; Heidor, R .; Pogribny, IP Epigenética Nutricional e a Prevenção do Carcinoma Hepatocelular com Constituintes Bioativos de Alimentos. Nutr. Câncer 2016 , 68 , 719–733. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Park, JS; Rho, HS; Kim, DH; Chang, IS Preparação enzimática de kaempferol de semente de chá verde e sua atividade antioxidante. J. Agric. Food Chem. 2006 , 54 , 2951-2956. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Nöthlings, U .; Murphy, SP; Wilkens, LR; Henderson, BE; Kolonel, LN Flavonols e risco de câncer pancreático: o estudo de coorte multiétnico. Sou. J. Epidemiol. 2007 , 166 , 924-931. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Cui, Y .; Morgenstern, H; Gronelândia, S.; Tashkin, DP; Mao, JT; Cai, L; Cozen, W .; Mack, TM; Lu, QY; Zhang, ZF Ingestão de flavonóides na dieta e câncer de pulmão - Um estudo de caso-controle de base populacional. Cancer 2008 , 112 , 2241–2248. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gacche, RN; Shegokar, HD; Gond, DS; Yang, Z; Jadhav, AD Avaliação de flavonóides selecionados como antiangiogênicos, anticancerígenos e radicais sequestradores: uma análise experimental e in silico. Cell Biochem. Biofísica 2011 , 61 , 651-663. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Calderón-Montaño, JM; Burgos-Morón, E .; Pérez-Guerrero, C; López-Lázaro, M. Uma revisão sobre o flavonóide dietético kaempferol. Mini Rev. Med. Chem. 2011 , 11 , 298-344. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Gupta, SC; Kim, JH; Prasad, S .; Aggarwal, BB Regulação da sobrevivência, proliferação, invasão, angiogênese e metástase de células tumorais através da modulação de vias inflamatórias por nutracêuticos. Metástase do Câncer Rev. 2010 , 29 , 405–434. [ Google Scholar ] [ CrossRef ] [ PubMed ] [ versão verde ]
- Hsu, CP; Shih, YT; Lin, BR; Chiu, CF; Lin, CC: efeito inibitório e mecanismos de um extrato rico em antocianinas e antocianidinas do chá roxo na proliferação de células de carcinoma colorretal. J. Agric. Food Chem. 2012 , 60 , 3686-3692. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Li, L; Adams, LS; Chen, S; Killian, C; Ahmed, A .; Seeram, NP Eugenia jambolana O extrato de Lamberry inibe o crescimento e induz a apoptose do câncer de mama humano, mas não de células mamárias não tumorigênicas. J. Agric. Food Chem. 2009 , 57 , 826-831. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Lu, JN; Lee, WS; Nagappan, A .; Chang, SH; Choi, YH; Kim, HJ; Kim, GS; Ryu, CH; Shin, SC; Jung, JM; et al. Antocianinas do fruto de VitiscoignetiaePulliat potenciam a atividade da cisplatina ao inibir as vias de sinalização PI3K / Akt em células cancerosas gástricas humanas. J. Cancer Prev. 2015 , 20 , 50-56. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Correu em.; Bharti, S .; Krishnamurthy, B; Bhatia, J; Sharma, C; Kamal, MA; Ojha, S .; Arya, DS Propriedades Farmacológicas e Potencial Terapêutico da Naringenina: Um Flavonóide Cítrico de Promessa Farmacêutica. Curr. Pharm. Des. 2016 , 22 , 4341-4359. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Mir, IA; Tiku, AB Potencial quimiopreventivo e terapêutico da naringenina, uma flavanona presente em frutas cítricas. Nutr. Câncer 2015 , 67 , 27-42. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Caselli, A .; Cirri, P; Santi, A .; Paoli, P. Morin: uma droga natural promissora. Curr. Med. Chem. 2016 , 23 , 774-791. [ Google Scholar ] [ CrossRef ] [ PubMed ]
- Yamamoto, T .; Sakamoto, C; Tachiwana, H; Kumabe, M; Matsui, T; Yamashita, T .; Shinagawa, M; Ochiai, K; Saitoh, N; Nakao, M. Células modelo de câncer de mama resistentes à terapia endócrina são inibidas pela glicolina I da soja através do RNA não-codificante de Eleanor. Sci. Rep. 2018 , 8 , 15202. [ Google Scholar ] [ CrossRef ] [ PubMed ]
© 2018 pelos autores. Licenciado MDPI, Basileia, Suíça. Este artigo é um artigo de acesso aberto distribuído sob os termos e condições da licença Creative Commons Attribution (CC BY) (http://creativecommons.org/licenses/by/4.0/ ).
