Agentes anti-câncer de mama derivados de plantas
Abstrato
Após o surgimento da moderna terapia antineoplásica, a comunidade médica é dividida em dois campos opostos, um deles afirmando absoluta necessidade de usar compostos químicos isolados ou sintetizados para tratamento eficiente do paciente e outro que defende terapias alternativas do câncer, em particular aquelas baseadas em fontes naturais, incluindo extratos de plantas. Parece, na realidade, que os dois campos são conciliáveis: enquanto fontes naturais, extratos de plantas ou sucos exercem um papel curativo e protetor, as drogas representam a última possibilidade de inibir ou reverter o desenvolvimento do tumor. Neste trabalho, tentamos analisar as potências anti-câncer de mama de vários extratos de diferentes fontes vegetais e comparar sua eficiência antiproliferativa de extratos brutos com ações de seus ingredientes purificados.
Palavras-chave
Extratos vegetais Câncer anti-mama Suco Chá Café Vinho1 Introdução
Agentes anti-câncer de mama selecionados isolados de diferentes espécies de plantas
Akaloides com maior atividade anti-câncer de mama
Outros inibidores de microtúbulos ou “agentes interativos tubulínicos”, alcalóides vincrstina e vinblastina (Fig. 2 ), isolados da pervinca de Madagascar Catharanthus roseus ou Vinca rosea,foram encontrados também ser eficientes no tratamento do câncer de mama. As drogas mencionadas são aquelas em centenas de substâncias naturais usadas durante séculos para tratar a doença e promover a saúde, e o tempo todo a medicina depende principalmente de plantas, extratos vegetais e outros produtos vegetais. A busca por novos agentes anticancerígenos de origem natural e sintética repousa um campo muito ativo da atividade científica, notadamente devido à resistência adquirida de células tumorais, única e múltipla droga, um fenômeno relativamente novo apareceu devido ao uso intenso de compostos anticâncer. Assim, drogas anticâncer que não servem como substratos para transportadores de múltiplas drogas, como “proteína de resistência ao câncer de mama”, BCRP e “proteína de resistência a múltiplas drogas”. P-glicoproteína, pode aumentar consideravelmente a eficiência da quimioterapia [ 20 ,21 , 22 , 23 ].
2 Extratos Vegetais como Potenciais Inibidores do Câncer de Mama
Estruturas de ácido ricinoleico e ácidos dicarboxílicos epoxídicos
Di-e triacilglicerídeos bioativos de ácido ricinoleico
De acordo com estimativas da Organização Mundial da Saúde, 80% da população mundial, especialmente os que vivem na Ásia, América Latina e África, ainda dependem de fitoterapia [ 31 , 32 , 33 , 34 , 35 , 36 ]. Não é de admirar que a triagem de fontes naturais para diferentes tipos de atividade biológica e potência medicinal seja realizada principalmente em plantas nativas, muitas vezes exóticas. Muitas vezes, uma atividade antiproliferativa dos extratos vegetais revelada em estudos in vitro não estava associada aos efeitos medicinais das formulações de ervas utilizadas pelos fitoterapeutas locais.
Vernonia amygdalina (VA), é uma planta de montanha africana comestível da família Asteraceae. É conhecido como “folha amarga”, eventualmente devido a quantidades elevadas de alcalóides, saponinas e taninos [ 37 ]. As folhas e as raízes deste arbusto são usadas na África Subsaariana para muitos propósitos, por exemplo, como um tônico, mas também para melhorar a digestão, reduzir a febre e proteger o organismo dos parasitas intestinais e dos dermátomos. V. extratos de amigdalina também foi encontrado para inibir a proliferação de células MCF-7 de câncer de mama [ 37 ]. A extração de VA com múltiplos solventes de vários índices de polaridade produziu três frações (A1-2, B-3) que inibiram significativamente o crescimento celular ( P <0,05) a 0,1 mg / mL. Em uma concentração maior (1 mg / mL), seis frações extraídas por hexano, clorofórmio, butanol e acetato de etila inibiram a síntese de DNA em 76-98%. As fraces obtidas inibiram tamb o crescimento da linha celular de cancro da mama MKL-F [ 30 , 37 ]. A interpretação desses efeitos não é simples, pois os extratos de folhas de V. amygdalina contêm vários ingredientes ativos potencialmente anticâncer de diferentes propriedades funcionais e estruturais, como antioxidantes (flavonóides), terpenóides lipofílicos (lactona sesquiterpênica) e saponinas anfifílicas.
Saponinas bioativas pfafosídeos A – G isoladas de um arbusto amazônico Suma, Pfaffia paniculata
Em alguns estudos de triagem, a parcela de plantas potencialmente úteis foi considerada extraordinariamente alta. Assim, foram coletadas 32 plantas nas florestas da Malásia e 143 extratos brutos foram avaliados quanto a suas atividades antiproliferativas em duas linhagens de câncer de mama, ou seja, MCF-7, o modelo de linhagem de câncer de mama mais comumente usado e células T47D. . Após a realização do exame sulforrodamina-B, 13 extractos em bruto a partir de 11 espécies de plantas foram encontrados para possuir uma actividade anti-proliferativa (IC 50 para os extractos secos foi de 0,1 mg / mL ou inferior) [ 42 ].
É preciso perceber que as chances de identificar extratos de plantas anticâncer realmente eficientes são muito baixas. De fato, quantas plantas podem ser consideradas fontes potenciais de compostos ativos? Qual é um valor de dose correspondente a uma fronteira entre a potência do extrato e a ineficiência? Dois estudos mencionados abaixo esclarecem parcialmente a incerteza.
As florestas tropicais brasileiras são caracterizadas pela variedade excepcional das formas de espécies vegetais. Não é de admirar que periodicamente tentativas tenham sido feitas para realizar a triagem global de extratos das plantas em busca de compostos potencialmente ativos. Assim, mais de 1000 extratos aquosos e orgânicos de 351 espécies foram verificados em uma dose de 0,1 mg / mL por suas capacidades de suprimir o crescimento de células MCF7. Surpreendentemente, apenas 11 extratos revelaram citotoxicidade acentuada nesta dose relativamente alta [ 43 ].
Outro estudo do faraó foi realizado em uma triagem de oito anos de plantas sul-africanas [ 44]. De um total de 7500 extratos vegetais selecionados em 60 linhagens de células humanas, os mais ativos foram testados em linhas celulares MCF7, câncer renal e melanoma. Os extratos foram separados em 4 grupos, de acordo com os valores de TGI (inibição de crescimento total):> 50 μg / mL (inativo), 15-50 μg / mL (fraco), 6,25-15 μg / mL (moderado) e <6,25 μg / mL (potente). Do total de cinquenta extratos ativos, nenhum deles foi potente no teste de MCF7, e apenas vinte apresentaram atividade inibitória moderada. À primeira vista, as conclusões desses dois estudos parecem ser frustrantes. No entanto, uma abordagem que consome mão-de-obra e muitas vezes altruísta, que lida com o teste de extratos de plantas cruas, muitas vezes leva à identificação de compostos ativos e à revelação de mecanismos celulares envolvidos nas ações citotóxicas [ 44 ].
Alguns triterpenóides lactona C28-esteróide bioativos, withanolides foram identificados a partir de ginseng indiano ( Withania somnifera )
A adriamicina também conhecida como adriacinona, adriblastina ou adriblastina é um antibiótico antitumoral isolado de Actinomadura roseola
3 Efeitos dos flavonóides da dieta na iniciação e progressão do câncer de mama
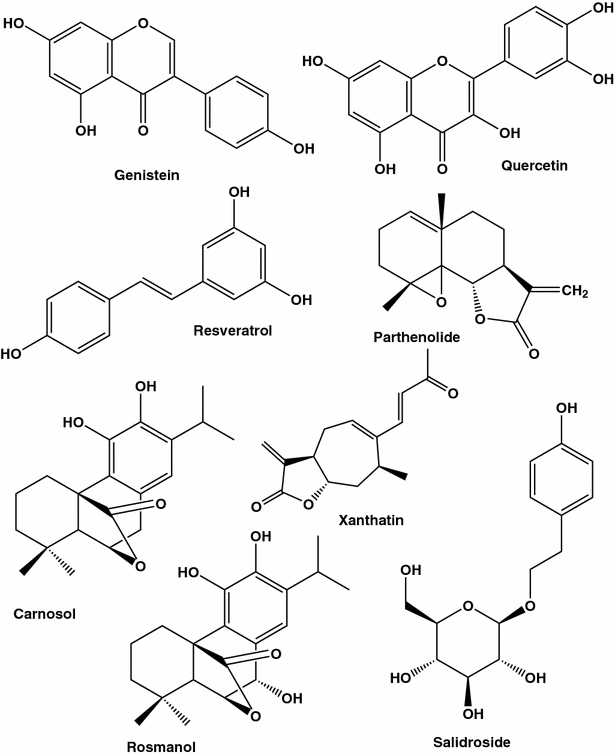
Existem inúmeros relatos de que uma dieta rica em flavonóides pode ser protetora contra vários tipos de câncer, desde câncer de ovário até câncer de pulmão e pâncreas. Quase 5000 flavonóides foram identificados em frutas e legumes. Os flavonóides de genisteína de referência (princípio isoflavonóide de soja) e quercetina (presentes em grandes quantidades nas peles de maçãs e cebolas vermelhas) mostraram inibir o crescimento de células tumorais. Embora estudos com culturas de animais e células indiquem que os efeitos preventivos do tumor dos flavonóides doadores de elétrons são devidos às suas propriedades de eliminação de radicais livres [ 48 , 49], mecanismos moleculares concretos para a atividade anticancerígena de cada flavonóide ativo ainda precisam ser revelados. O espectro de efeitos flavonóides se espalha a partir da inibição de quinases dependentes de ciclina (CDKs), que são críticas para o crescimento e divisão celular, para bloquear a angiogênese e modular a atividade da MDR1. Por exemplo, a genisteína (Fig. 1 ) mostrou ser muito eficiente na indução de apoptose em linhagens de células de câncer de mama MCF-7 e T47D [ 50]. É de mencionar que os ensaios clínicos de larga escala não forneceram conclusões decisivas de que esses antioxidantes previnem o câncer ou retardam a doença. Toda a área que lida com os benefícios de saúde dos antioxidantes e, em particular, a sua atividade anticancerígena entra em turbulência. De fato, os sequestradores de radicais livres protegeriam o DNA de danos e impediriam a transformação celular em um tipo maligno, mas, por outro lado, poderiam melhorar a sobrevivência das células. Esta natureza dupla face de antioxidantes foi revelada em estudos recentes mostrando a influência protetora de antioxidantes nas células tumorais. Em particular, em células epiteliais da mama humanas desprovidas de matriz extracelular, os antioxidantes estimularam a oxidação dos ácidos gordos, restaurando assim a síntese de ATP e prevenindo a morte celular não apoptótica [ 51 ].
Dois alcalóides anti-câncer de mama: rohitukine foi isolado de Amoora rohituka , flavopiridol é um derivado de flavona semi-sintético
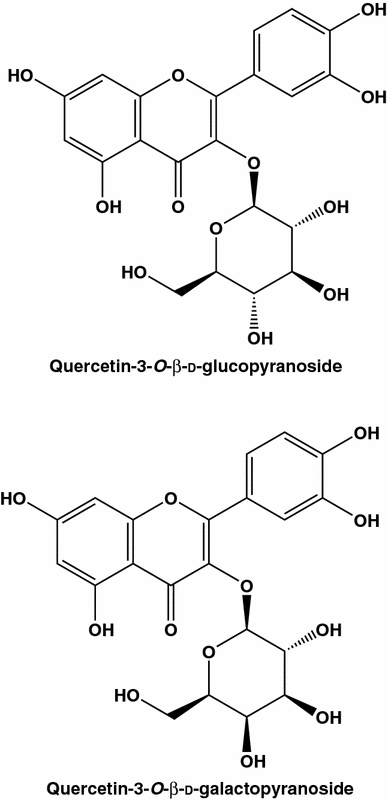
Outro exemplo de um polifenol que exerce tanto a protecção celular como o efeito de destruição das células cancerígenas é a quercetina (Fig. 1 ). Sugere-se que este flavonóide presente em quantidades elevadas em algumas frutas e vegetais exerça estas ações opostas desempenhando um papel de antioxidante devido a quelantes de metais e eliminação de radicais livres, e um papel de pró-oxidante devido a sua capacidade de gerar EROs. A última espécie pode a priori induzir dano ao DNA [ 61 ]. Foram relatados numerosos efeitos da quercetina sobre as funções celulares do cancro da mama, da indução de p21 (inibidor de CDK) e paragem do ciclo celular em G 1 ou G 2 / M [ 62] à apoptose, que pode ser devido à ativação de caspases, modificação de microtúbulos e aumento da expressão de proteínas de estresse [ 61 ]. Nenhum estudo foi feito em nível de tecido. Com relação aos resultados obtidos in vitro, na maioria dos estudos realizados em linhagens de células de câncer de mama este flavonóide foi testado em altas concentrações, variando de 10 a 200 µM. Por exemplo, a uma concentração relativamente elevada (10 µM), a quercetina induziu apenas danos ligeiros ao ADN e 94% das células SK-Br3 permaneceram viáveis mesmo após 4 dias de incubação nesta concentração de quercetina [ 61].
Para avaliar as possíveis atividades anticancerígenas dos flavonóides da dieta, como a quercetina, deve-se comparar os níveis plasmáticos do composto natural ingerido com aqueles utilizados em estudos sobre modelos de câncer. Embora apenas 0,35-1,4% de quercetina ingerida no café da manhã seja excretada em 24 horas, seu nível de pico no plasma sanguíneo é bastante baixo: 0,6 µM (consumo de maçã) e 0,74 µM (consumo de cebola) [ 63 ]. Levando em consideração que o consumo de uma única porção de cebola corresponderia à ingestão de aproximadamente 200 µmol de quercetina, pode-se concluir que uma fração maior do flavonóide é metabolizada ou absorvida pelos tecidos.
Os principais flavonóides das cascas de maçã são conhecidos como agentes anticancerígenos
Tentativas foram feitas para correlacionar eficiências anti-câncer de extratos de maçã com os de compostos individuais. Um dos estudos [ 64 ] indica que o extracto de maçã e quercetina-3-β- d-glucoside (Q3G) possuem actividade anti-proliferativa contra células MCF-7 (os correspondentes CE 50 valores de 71 ug / ml e 46? M). A combinação bidirecional de extratos de maçã e Q3G aumentou significativamente a ação antiproliferativa nas células. A CE 50os valores foram reduzidos para 33,8 µg / mL e 10,8 µM, respectivamente. Deve-se enfatizar que a comparação de eficiências de extratos brutos e seus ingredientes individuais é possível somente em bases de peso / volume. Neste caso, o último estudo indicaria que o extrato de maçã possui maior antiproliferativa que o Q3G. Com efeito usando em peso / volume CE 50 valores (71 e 29 ug / mL, respectivamente) e tendo em consideração muito baixos níveis de Q3G em maçãs [ 64], pode-se concluir que este último análogo quercetina devem ser excluídos da lista de potenciais agentes anti drogas de câncer. Influências sinérgicas únicas dos compostos existentes nas plantas comestíveis reforçam a posição dos seguidores da medicina alternativa.
No presente, falta-nos uma evidência direta da ligação entre a eficiência antiproliferativa de um ingrediente vegetal comestível in vitro e sua atividade anticancerígena in vivo. Por exemplo, a dieta mediterrânea, caracterizada pelo alto consumo de frutas e vegetais, é tradicionalmente considerada uma das mais saudáveis, proporcionando proteção ao organismo contra doenças cardiovasculares e câncer. Numerosos estudos indicam que extratos de plantas comestíveis de áreas mediterrâneas possuem atividade antiproliferativa quando avaliados em diferentes linhas celulares de câncer. Utilizando o ensaio de sulforodamina B, os extractos de dezasseis plantas, comidos cozidos, fritos ou frescos no sul da Itália, foram testados em quatro linhas celulares de cancro humano, incluindo o MCF-7 [ 65]. Nenhuma correlação clara foi obtida entre o nível de flavonóides e os efeitos inibitórios. Assim, o cardo da ave Sonchus oleraceus com o maior teor de flavonóides (33 mg / g de extrato seco) foi menos eficiente (8,4% de inibição a 100 μg de extrato hidroalcoólico / mL) do que a alcachofra selvagem Cynara cardunculus (9 mg / g e 22,7 %) ou Caperis sicula (2,52 mg / g e 42,67%), muito rico em quercetina. Por outro lado, extratos de hortelã-d'água Mentha aquatica mostrando a melhor atividade antiproliferativa na linhagem MCF-7 (44,7% de inibição) foram caracterizados por níveis relativamente altos de flavonoides (15,75 mg / mL) e um extraordinário alto conteúdo fenólico total (337 mg / g).
Outro exemplo de natureza de dupla face da quercetina e toda a classe de flavonóides está associado à sua semelhança estrutural com os estrogênios celulares. Os receptores de estrogênio são um dos alvos da terapia anti-câncer de mama. Flavonóides de plantas medicinais são considerados como fitoestrogênios fracos para poder imitar os efeitos do estrogênio. O alto consumo de fitoestrógenos é benéfico a priori para mulheres na pós-menopausa, embora ainda não sejam obtidos dados diretos sobre suas ações de alívio nos sintomas da menopausa. A revisão de dados epidemiológicos, bem como experimentos in vitro em linhagens de células de mama ER-positivas e ER-negativas [ 66] permitiu postular que os fitoestrogênios podem exercer duas ações opostas, dependendo de seu nível no sangue e concentrações usadas em estudos experimentais: Em concentrações, não excedendo 10 µM, alguns fitoestrogênios, como a genisteína, estimulam o crescimento de ER positivo para MCF-7 e T Linhas celulares -47D, mas n as linhas celulares de cancro da mama ER-negativas MDA-MB 231/435. Em concentrações mais altas, a sobrevida de ambos os tipos de células de câncer de mama de ambos os tipos diminui. Em doses baixas, os fitoestrógenos, como ligandos do ER, provavelmente estimulam diretamente as vias metabólicas, proporcionando e / ou melhorando a proliferação celular, em particular a progressão do ciclo celular e a inibição da apoptose. Em concentrações mais elevadas, mecanismos que não são dependentes da sinalização de ER, incluindo aqueles associados às propriedades pró-oxidantes dos flavonóides, parecem ser desencadeados. No geral,66 ].
4 Sucos como Fontes de Inibidores Potenciais do Câncer de Mama
Compostos fenólicos e seus glicosídeos são constituintes de muitas frutas e vegetais, e têm atraído grande interesse público e científico por causa de seus potenciais efeitos anticancerígenos e outros promotores de saúde como antioxidantes [ 2 , 3 , 5 , 67 , 68 ].
Os benefícios de uma planta, provavelmente mais citados na literatura, a oliveira, para a saúde são conhecidos desde os tempos bíblicos. No entanto, na maioria dos casos, os efeitos benéficos do azeite de oliva são enfatizados, tendo em mente altos teores de ácidos graxos monoinsaturados, como o ácido oleico (compreendendo 50-80% do FA total) nos frutos. Uma vez que as azeitonas também são conhecidas por serem ricas em antioxidantes polifenólicos, as propriedades preventivas anticancerígenas do azeite descritas na literatura médica são provavelmente devidas à proteção do DNA de espécies reativas de oxigênio (ROS).
Dois grupos espanhóis investigaram as potencialidades anticancerígenas do azeite extra-virgem (EVOO). Em um dos estudos [ 69 ] os efeitos do EVOO dietético em adenocarcinomas mamários de ratos induzidos experimentalmente foram comparados com aqueles obtidos em animais colocados em dieta de óleo de milho. Tumores de ratos alimentados com a dieta de azeite foram caracterizados por um fenótipo mais benigno, enquanto aqueles de ratos em dieta de milho foram mais agressivos. Além disso, a dieta do azeite diminuiu a ativação do proto-oncogene p21Ras e aumentou a via de Raf / Erk, em comparação com o controle, enquanto a dieta com óleo de milho não modificou a atividade de Ras e aumentou a via de Raf / Erk. Concluiu-se que dois tipos de dietas de óleo exerceram seus efeitos através de um equilíbrio diferente de proliferação / apoptose e, provavelmente, níveis distintos de danos no DNA.
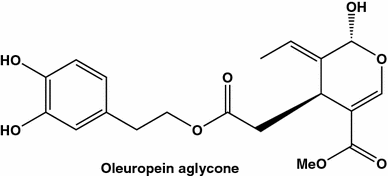
Aglicone oleuropein do agente anticanceroso isolado do azeite virgem
A amora americana ( Vaccinium macrocarpon ), que é muito rica em compostos fenólicos, como flavonóides, antocianinas, proantocianidinas e pequenos ácidos fenólicos, possui uma das maiores capacidades de eliminação de radicais livres. Foi demonstrado que 20 h de incubao de culas de cancro da mama humano (linhas MCF-7, MDA-MB-231 e MDA-MB-435) em 6,7% de sumo de amora induziu morte de 20% da populao celular [ 71 , 72 ].
O gênero Citrus inclui várias espécies, desde laranja doce ( S. sinensis ) até mandarine ( C. reticulate ) e híbridos múltiplos, representa uma fonte extraordinária de flavonóides, e seu conteúdo nos sucos de frutas chega a 1 µg / mL [ 73 ]. Nos anos anteriores, a maior parte da atenção tem sido atraída para os flavonóides cítricos, devido aos seus efeitos anti-inflamatórios e à sua capacidade de diminuir a permeabilidade capilar. Estudos recentes também estão focados na prevenção do desenvolvimento de câncer pelos sucos de frutas, extratos de frutas e compostos individuais isolados dos citros. Os principais flavonóides cítricos incluem quercitrina (quercetina-3- O- ramnosídeo), rutina (quercetina-3- O-rutinoside), tangeritina e hesperidina.
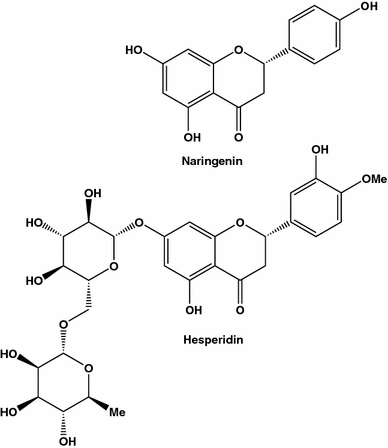
Dois compostos anti-câncer de mama (MDA-MB-435): naringenina, também conhecida como 4 ′, 5,7-tri-hidroxi-flavanona, S- dihidrogenisteína, salipurol ou salipurpol, e segunda - hesperidina, também conhecida como 7- (6- O -α- l -rhamnosyl- d -glucoside), atripliside B, cirantin ou hesperitina-7 ramnoglucosídeo, isolado a partir de toranja e laranja, respectivamente
O sinergismo descoberto pode ser devido a diferentes vias de inibição ativadas pelos compostos estudados. Em outro estudo, os efeitos inibitórios de sucos de laranja e toranja de força dupla na tumorigênese de rato mamário induzida por DMBA foram comparados [ 75 ]. Apesar do fato de a naringenina e a hesperetina estarem presentes em laranjas e toranjas em concentrações semelhantes, o suco das laranjas foi mais eficaz que o suco de grapefruit. Os resultados desses dois estudos confirmam que os compostos ativos são mais eficazes quando consumidos a partir de extratos brutos do que em formas isoladas (para a atualização de vários efeitos dos flavonóides cítricos e possíveis mecanismos de sua ação, ver revisão) [ 76 ]).
As crenças na medicina popular milagrosa podem complicar os efeitos sóbrios de apreciação dos extratos brutos. Assim, uma planta medicinal tradicional Tahitian Morinda citrifoliaAcredita-se que (noni) produza numerosos efeitos terapêuticos, desde ações hipotensivas e antiinflamatórias até atividade antitumoral. Esta planta também foi relatada para ter atividades antibacterianas, antivirais, antifúngicas, anti-helmint e analgésicas. Embora compostos ativos da planta não tenham sido identificados, ensaios foram realizados para testar sua eficiência anticâncer. Assim, os extractos de metanol obtidos a partir dos frutos de noni foram verificados quanto actividade citotica utilizando diferentes linhas celulares de cancro. Na concentração de 0,1 mg / mL, o extrato bruto demonstrou muito pouca citotoxicidade para as células BHK, Hep2 e Vero, enquanto sua atividade citotóxica mostrou-se pronunciada em experimentos em linhagens celulares de neuroblastoma (LAN5) e MCF-7 [ 77 ]. Sumo de fruta de M. citrifoliafoi mostrado para tratar o câncer de mama, bem como para inibir as metástases e até mesmo destruir células de câncer de mama metastatizadas, ver patente correspondente [ 78 ].
Principais compostos de suco de Brassica olearacea
Outro estudo indica que compostos presentes em vegetais crucíferos podem produzir efeitos opostos em células positivas para estrogênio. Extratos de acetato de etila de repolho e couve de Bruxelas foram analisados quanto a sua atividade estrogênica e anti-estrogênica, seguindo a proliferação induzida por estradiol de células MCF-7 e alterações no nível de mRNA de pS2 responsivo a estrogênio. Em baixas doses (5-25 ng / mL) os extratos inibiram a proliferação e diminuíram a expressão do gene pS2. No entanto, concentrações mais elevadas (50 ng / mL-25 µg / mL) aumentaram a proliferação de MCF-7 [ 81 ]. Concluiu-se que, embora compostos estrogênicos e antiestrogênicos pareçam estar presentes em vegetais crucíferos, não é provável que as concentrações que estimulam o crescimento do câncer de mama dependente de estrogênio possam ser alcançadas no organismo.
5 propriedades anti-câncer de chás e café
A evidência epidemiológica do potencial preventivo e curativo do chá ( Camellia sinensis ) não é consistente. Isso pode ser explicado por grandes variedades de chá consumidas nos países ocidentais (predominantemente chá preto) e nos países asiáticos (chá verde). Entretanto, as propriedades anticancerígenas do chá verde são conhecidas há muitos anos, e são presumivelmente devidas ao alto teor de polifenóis extraíveis com água, que é 5-10 vezes menor em um derivado do chá verde oxidado obtido após a fermentação (chá preto) [ 82 ].
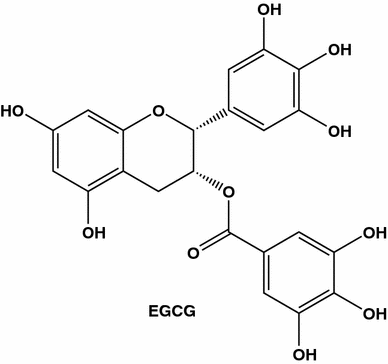
EGCG (também conhecido como epigalocatequina galato, epigalocatequina-3-monogalato, l- galeato de galato de epigalocatequina, epi-galocatequina 3- O- galato ou epi-galocatequina galato) é o principal polifenol do chá verde
Efeitos pró-apoptóticos diretos de extratos de chá verde e catequinas do chá em células tumorais in vitro e in vivo também foram demonstrados. Quando testado em diferentes linhas celulares de cancro da mama, o EGCG revelou uma modesta actividade pró-apoptótica. Contudo, o tratamento de culas 4T1 com EGCG em combinao com taxol conduziu a um aumento dramico na apoptose celular em comparao com o tratamento apenas com taxol [ 85 ]. A estrutura química do EGCG fornece sua capacidade de ser um agente quelante de metal e possuir, dependendo de sua concentração, atividade pró ou antioxidante. Diferentes ações do EGCG foram resumidas em uma revisão [ 86]. Outros estudos também indicam que o chá verde inibe a angiogênese. Foi demonstrado que extratos brutos de chá verde e EGCG, o principal polifenol do chá verde, diminuíram de forma dependente da dose a transcrição do fator de crescimento endotelial vascular (VEGF) e inibiram células endoteliais de células de câncer de mama MDA-MB231 e células umbilicais humanas (HUVEC) proliferação. Em modelos de tumor de camundongos, os extratos de chá verde suprimem a angiogênese, que se manifestou pela diminuição das áreas de necrose e pela menor densidade dos vasos sanguíneos nos xenoenxertos tratados [ 83 ].
Em um estudo de 7 anos com 472 pacientes com estágios I-III de câncer de mama, foi demonstrado que o aumento do consumo de chá verde, 4-5 xícaras por dia, estava associado à diminuição do número de metástases linfonodais axilares no grupo de pacientes na pré-menopausa. com estágios I e II e aumento da expressão de receptores de estrogênio e progesterona em pós-menopausa. Ele foi significativamente associado com a melhora do prognóstico dos estágios de câncer de mama I e II, enquanto nenhuma melhora no prognóstico foi observada no câncer de mama estágio III [ 87 ]. Em um estudo caso-controle de base populacional a longo prazo [ 88], risco de câncer de mama foi relacionado com o início do consumo de chá verde e status menopausal. No grupo de mulheres na pré-menopausa, foi encontrada uma relação direta entre o risco reduzido e anos de consumo de chá verde, bem como a quantidade de chá consumido mensalmente. Surpreendentemente, entre as mulheres na pós-menopausa, o risco diminuído de câncer de mama foi associado a uma idade mais avançada de início do consumo de chá. Globalmente, este estudo indicou que o consumo regular de chá verde foi inversamente associado ao risco de câncer de mama [ 89 ].
Uma equipe conjunta dos EUA e da Coréia do Sul estimou o conteúdo de diferentes flavonóides em 15 chás comerciais, incluindo chás preto e verde e comparou ações anticarcinogênicas de compostos de chá individuais, como nove catequinas do chá verde, três teaflavinas do chá preto e extratos do mesmo. folhas de chá. A maioria dos compostos testados e todos os extratos de chá inibiram o crescimento da linhagem de células MCF-7. Outras linhas celulares (linhas celulares de cólon, fígado e próstata) também foram inibidas. Uma das conclusões deste estudo foi que os níveis dos flavonóides do chá não se correlacionam diretamente com as atividades anticancerígenas. Além disso, ambos os chás verde e preto foram encontrados para possuir potenciais anticancerígenos semelhantes. Em qualquer caso, os consumidores podem beneficiar mais bebendo chás verde e preto [ 90 ].
Resultados conflitantes obtidos em estudos epidemiológicos sobre os efeitos do chá preto e do café no desenvolvimento e na progressão do câncer de mama podem ser devidos a deficiências no controle preciso do status dos receptores hormonais e a fatores como tabagismo, hábitos alimentares e frequência de consumo diário. Um grupo sueco acompanhou prospectivamente 61433 mulheres que não tinham câncer em 1987-1990 e algumas delas desenvolveram câncer de mama invasivo [ 91 ] .]. Os resultados deste estudo indicam que o consumo de chá preto pode estar positivamente associado ao risco de tumores ER + / PR +. O estudo mencionado também revelou uma correlação não significativa entre o aumento da ingestão de café e o risco de câncer de mama no grupo ER + e a correlação inversa no grupo ER-. Um estudo sueco mais recente forneceu fortes evidências de que o consumo de café diminuiu o risco global de câncer de mama de câncer de mama. O risco diminuiu em 57% ( P = 0,0003) e 33% ( P = 0,034). Para mulheres que consumiram mais de cinco xícaras de café por dia, os riscos foram de 57% ( P = 0,0003) e 33% ( P = 0,034) na doença dos grupos ER-negativo e PR-negativo, respectivamente [ 92]. Nenhuma redução na incidência de risco de câncer de mama foi encontrada no grupo ER-positivo.
6 Vinho como fonte de inibidores potenciais do câncer de mama
As uvas, uma das frutas mais populares e mais amplamente cultivadas em todo o mundo, contêm grandes quantidades de fitoquímicos, incluindo antocianinas e resveratrol (Fig. 1 ), que oferecem benefícios para a saúde [ 93 ]. Os efeitos benéficos relacionados com a saúde dos fenólicos nas uvas são importantes para os consumidores, criadores e a indústria da uva.
O vinho tinto é uma fonte rica de componentes polifenólicos. Os efeitos inibitórios dos polifenóis do vinho tinto em células de câncer de mama humano foram demonstrados anteriormente por muitos autores [ 94 , 95 , 96 , 97 , 98 ]. As uvas fenólicas, flavonóides e resveratrol, dos vinhos Pinot Noir, Cabernet Franc, Chardonnay, Catawba, Concord, Sheridan, Niagara e Riesling inibiram significativamente a proliferação de células cancerígenas humanas Caco-2, HepG2 e MCF-7 [ 95 ]. As frações flavonóides do vinho tinto Merlot mostraram inibição máxima do crescimento de células de câncer de mama, com citotoxicidade relativamente baixa para células epiteliais mamárias humanas (HMEC) e células de câncer de mama humano (MCF-10A) [ 99] e células de câncer de mama MCF-7 [ 100 ].
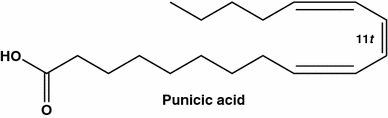
Ácido natural raro, ácido púbico (9 c , 11 t , 13 c -18: 3) de Punica granatum
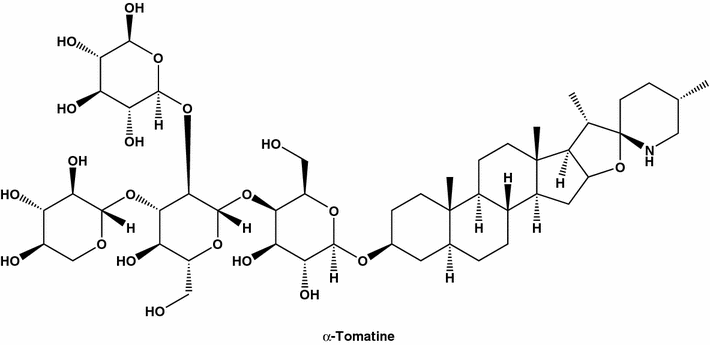
a-Tomatina, também conhecida como espiro [8H-nafta [2 ', 1': 4,5] indeno [2, 1-b] furano-8, 2 '-piperidina], derivado do p- d -galactopiranósido ; O spirosolane, ou lycopersicin, é um forte inibidor da mama humana (MDA-MB-231). A tomatina foi isolada pela primeira vez a partir de extratos de plantas de tomateiro infectadas com galha de coroa
7 Observações Finais
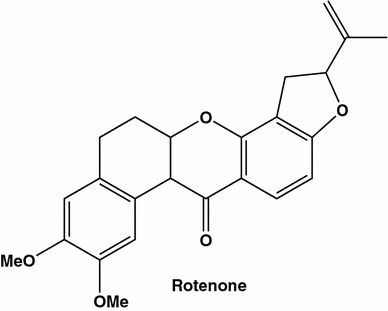
A partir desta revisão dificilmente exaustiva, pode-se chegar a uma conclusão bem simples [ 106 , 107 , 108 , 109 ]. A rejeição do tratamento convencional do câncer pelos seguidores da fitoterapia tradicional é razoável devido ao fato conhecido pelos seres humanos e todas as espécies animais: cada planta e suco que pode ser consumido é seguro. Muitas vezes, no entanto, os tradicionalistas tentam evitar outro fato: os ingredientes vegetais ativos na maioria dos casos representam toxinas matando a célula, como o taxol. Algumas das toxinas derivadas de plantas visam várias vias metabólicas. Um dos exemplos é o conhecido inibidor da cadeia de transporte de elétrons mitocondrial, a rotenona [ 114 , 115 , 116 ,117 ].
No século XIX, viajantes em países equatoriais forneceram relatórios sobre o uso de certas plantas, pertencentes à família Fabaceae, ou Papilionaceae , para capturar e matar peixes. O ingrediente da planta de intoxicação por peixe foi posteriormente identificado como isoflavonóide. Este "ichthyocide", rotenona, tem sido amplamente utilizado em solução como pesticida e inseticida.
Abordagens tradicionais e modernas para prevenção e tratamento do câncer podem co-existir sendo complementares. De facto, numerosos testes sobre a sobrevivência e proliferação de células cancerígenas revelaram fortes efeitos aditivos ou sinérgicos de combinações de fármacos / extractos anticancerosos de uma planta que podem diminuir a toxicidade inespecífica de fármacos antineoplásicos. A ação sinérgica não pode ser razoavelmente explicada sem o conhecimento da composição exata de ingredientes presumivelmente ativos nos extratos e sucos. Esta ação pode ser devida ao aumento da biodisponibilidade ou estabilidade das drogas anticâncer, ativação ou inibição de vias metabólicas modificando os níveis de proteínas pró e anti-apoptóticas. Em qualquer caso, experimentos in vitro sobre linhagens de células cancerosas precisam ser confirmados por estudos clínicos.
Outra observação provavelmente menos fundamentada é que os extratos vegetais “seguros” ajudariam as células a sobreviver sob condições que progressivamente quebrariam o maquinário intracelular (pode-se mencionar atividades de eliminação de radicais livres). Por outro lado, os medicamentos modernos mais eficientes matam as células, sem discriminar células normais e cancerígenas (para mencionar aqui os ataques de radicais livres). Não importa que a célula cancerosa, devido à sua extraordinária atividade proliferativa, seja mais vulnerável a agentes que danificam o DNA ou que bloqueiam o ciclo celular. Uma única mutação celular saudável pode provocar sua transformação em um fenótipo maligno. Em qualquer caso, as combinações de tratamento medicamentoso e medicina tradicional não têm sentido e, em algumas situações, podem ser prejudiciais para o paciente.
Notas
Conflito de interesses
Os autores declaram não haver conflito de interesses.
Referências
-
1VM Dembitsky, Phytomedicine 21 , 1559-1581 (2014)PubMedGoogle Acadêmico
-
2DV Kuklev, VM Dembitsky, Prog. Lipid Res. 56 , 67–91 (2014)PubMedGoogle Acadêmico
-
3VM Dembitsky, Chem. Biodiversos 1 , 673–781 (2004)PubMedGoogle Scholar
-
4VM Dembitsky, Eur. J. Med. Chem. 43 , 223–251 (2008)PubMedGoogle Scholar
-
5VM Dembitsky, S. Poovarodom, H. Leontowicz, M. Leontowicz, S. Vearasilp, S. Trakhtenberg, S. Gorinstein, Food Res. Int. 44 , 1671–1701 (2011)Google Acadêmico
-
6S. Katz, Can. J. Plant Pathol. 24 , 10–13 (2002)Google Acadêmico
-
7LC Tapsell, I. Hemphill, L. Cobiac, Patch CS, DR Sullivan, M. Fenech, Roodenrys S., JB Keogh, PM Clifton, Williams PG, VA Fazio, KE Inge, Med. J. Aust. 185 (4 Supl.), S4-S9 (2006)PubMed Bolsa doGoogle Acadêmico
-
8J. Molnar, H. Engi, J. Hohmann, P. Molnar, J. Deli, O. Wesolowska, K. Michalak, Q. Wang, Curr. Topo. Med. Chem. 10 , 1757–1772 (2010)PubMedGoogle Scholar
-
9VM Dembitsky, DO Levitsky, Nat. Prod. Comum. 1 , 405–430 (2006)Google Acadêmico
-
10VM Dembitsky, Levitsky, TA Gloriozova, VV Poroikov, Nat. Prod. Comum. 1 , 773–812 (2006)Google Acadêmico
-
11A. Micheli, R. Ciampichini, W. Oberaigner, L. Ciccolallo, E. de Vries, I. Izarzugaza, Eur. J. Câncer 45 , 1017-1027 (2009)PubMedGoogle Acadêmico
-
12MS Copley, HA Bland, P. Rose, M. Horton, RP Evershed, Analista 130 , 860-871 (2005)PubMedGoogle Acadêmico
-
13EA Mazzio, KFA Soliman, Phytother. Res. 24 , 1813–1824 (2010)PubMedCentralPubMedGoogle Acadêmico
-
14JO Robinson, Am. J. Surg. 151 , 317–333 (1986)PubMedGoogle Scholar
-
15A. Scarpa, A. Guerci, J. Ethnopharmacol. 5 , 117–137 (1982)PubMedGoogle Scholar
-
16C. Ferlini, I. Ojima, M. Distefano, D. Gallo, A. Riva, P. Morazzoni, E. Bombardelli, S. Mancuso, G. Scambia, Curr. Med. Chem. Anti-Cancer Agents 3 , 133–138 (2003)PubMedGoogle Scholar
-
17X. Ele, RH Liu, J. Agric. Food Chem. 56 , 9905–9910 (2008)PubMedGoogle Scholar
-
18MC Wani, HLTaylor, ME Wall, J. Am. Chem. Soc. 93 , 2325–2327 (1971)PubMedGoogle Scholar
-
19DA Fuchs, RK Johnson, Cancer Treat. Rep. 62 , 1219–1222 (1978)PubMedGoogle Scholar
-
20A. El-Sayed, GA Cordell, J. Nat. Prod. 44 , 289–293 (1981)PubMedGoogle Scholar
-
21A. El-Sayed, GA Handy, GA Cordell, J. Nat. Prod. 46 , 517-527 (1983)PubMedGoogle Scholar
-
22D. Leveque, F. Jehl, Clin. Pharmacokinet. 31 , 184–197 (1996)PubMedGoogle Acadêmico
-
23ME Wall, MC Wani, Cancer Res. 55 , 753–760 (1995)PubMedGoogle Scholar
-
24AH Atta, SM Mouneir, J. Ethnopharmacol. 92 , 303–309 (2004)PubMedGoogle Scholar
-
25G. Stubiger, E. Pittenauer, G. Allmaier, Phytochem. Anal. 14 , 337–346 (2003)PubMedGoogle Scholar
-
26Z. Chen, JX Zhang, G. Chen, J. Chromatogr. 863B , 101–106 (2008)Google Acadêmico
-
27SVS Chakravartula, N. Guttarla, Nat. Prod. Res. 21 , 1073–1077 (2007)PubMedGoogle Scholar
-
28.W. Johnson, Int. J. Toxicol. 26 , 31-77 (2007)Google Acadêmico
-
29G. Alibert, Z. Mouloungui, R. Grison, M. Romestan, Corps Gras Lipides 8 , 98–102 (2001)Google Acadêmico
-
30DA Oyugi, X. Luo, KS Lee, B. Hill, EB Izevbigie, Exp. Biol. Med. 234 , 410–417 (2009)Google Acadêmico
-
31E. Yesilada, Chin. J. Integr. Med. 17 , 95–98 (2011)PubMedGoogle Scholar
-
32CA Pereira, PLL Silva, AD Correa, J. Med. Plantas Res. 4 , 2305–2312 (2010)Google Acadêmico
-
33SJ Ameh, OO Obodozie, EUA Inyang, MS Abubakar, M. Garba, J. Med. Plantas Res. 4 , 72–81 (2010)Google Acadêmico
-
34GB Mahady, J. Nutr. 131 (Suppl. 3), 1120–1124 (2001)Google Acadêmico
-
35CJ Hardwicke, Reação Adversa a Medicamentos. Toxicol Rev. 21 , 51–99 (2002)PubMedGoogle Scholar
-
36N. Robinson, Complemento. Ther. Clin. Prática 12 , 132–140 (2006)PubMedGoogle Scholar
-
37C. Yedjou, E. Izevbigie, P. Tchounwou, P. Int. J. Environ. Res. Saúde Pública 5 , 337–341 (2008)Google Scholar
-
38Para Fontanive, C. Kobayashi, L.R. Bona, T. Massoni, M. Weizenmann, T. Tasca, GD Gamaro, RW Maluf, SU Picoli, P. Ardenghi, ES Suyenaga, Lat. Sou. J. Pharm. 29 , 64–71 (2010)Google Acadêmico
-
39S. Nakai, N. Takagi, H. Miichi, S. Hayashi, N. Nishimoto, T. Takemoto, H. Kizu, Fitoquímica 23 , 1703–1705 (1984)Google Acadêmico
-
40.FO Kagiki, GC Goncalves, ET Oliveira, OJ Crocomo, LA Gallo, Rev. Bras. Plantas Med. 7 , 43–49 (2004)Google Acadêmico
-
41.MK Nagamine, TC da Silva, P. Matsuzaki, KC Pinello, B. Cogliati, CR Pizzo, Exp. Toxicol Pathol. 61 , 75–82 (2009)PubMedGoogle Scholar
-
42.MY Nurhanan, O. Asiah, MAM Ilham, MMS Syarifah, I. Norhayati, HL Sahira, J. Trop. Para. Sci. 20 , 77–81 (2008)Google Acadêmico
-
43.IB Suffredini, MLB Paciência, SA Frana, AD Varella, RN Younes, Pharmazie 62 , 798-800 (2007)PubMedGoogle Acadêmico
-
44G. Fouche, GM Cragg, P. Pillay, N. Kolesnikova, VJ Maharaj, J. Senabe, J. Ethnopharmacol. 119 , 455–461 (2008)PubMedGoogle Scholar
-
45MS Ali-Shtayeh, Z. Yaniv, J. Mahajna, J. Ethnopharmacol. 73 , 221–232 (2000)PubMedGoogle Scholar
-
46M. Kaileh, BW Vanden, E. Boone, T. Essawi, G. Haegeman, J. Ethnopharmacol. 113 , 510–516 (2007)PubMedGoogle Scholar
-
47B. Jayaprakasam, Y. Zhang, N. Seeram, M. Nair, Life Sci. 74 , 125–132 (2003)PubMedGoogle Scholar
-
48I. Orhan, M. Kartal, M. Abu-Asaker, SF Sezer, G. Yilmazand, B. Sener, Food Chem. 114 , 276–281 (2009)Google Acadêmico
-
49.G. Miliauskas, PR Venskutonis, TA van Beek, Food Chem. 85 , 231–237 (2003)Google Acadêmico
-
50Z. Yu, L. Zhang, D. Wu e Weisheng Yanjiu 32 , 125–133 (2003)PubMedGoogle Acadêmico
-
51ZT Schafer, AR Grassian, L. Song, Z. Jiang, Z. Gerhart-Hines, HY Irie, S. Gao, P. Puigserver, JS Brugge, Nature 461 , 109–113 (2009)PubMedCentralPubMedGoogle Acadêmico
-
52GM Cragg, DJ Newman, J. Ethnopharmacol. 100 , 72–79 (2005)PubMedGoogle Scholar
-
53AD Harmon, U. Weiss, JV Silverton, Tetrahedron Lett. 8 , 721–724 (1979)Google Acadêmico
-
54PJ Houghton, Y. Hairong, Planta Med. 53 , 262-264 (1987)PubMedGoogle Scholar
-
55AD Lakdawala, MV Shirole, SS Mandrekar, AN Dohadwalla, Ásia Pac. J. Pharm. 3 , 91–98 (1988)Google Acadêmico
-
56IS Ismail, Y. Nagakura, Y. Hirasawa, T. Hosoya, M. Lazim, M. Izwan, NH Lajis, M. Shiro, H. Morita, J. Nat. Prod. 72 , 1879–1883 (2009)PubMedGoogle Scholar
-
57Y. Takada, BB Aggarwal, J. Biol. Chem. 279 , 4750–4759 (2004)PubMedGoogle Scholar
-
58HH Sedlacek, J. Tcheco, R. Naik, G. Kaur, P. Worland, M. Losiewicz, B. Parker, B. Carlson, A. Smith, Int. J. Oncol. 9 , 1143–1168 (1996)PubMedGoogle Scholar
-
59BA Carlson, MM Dubay, EA Sausville, L. Brizuela, P. Worland, J. Cancer Res. 56 , 2973–2978 (1996)Google Acadêmico
-
60AR Tan, SM Swain, Semin. Oncol. 29 , 77–85 (2002)PubMedGoogle Scholar
-
61J. Jeong, JY An, YT Kwon, J.G Rhee, YJ Lee, J. Cell. Biochem. 106 , 73–82 (2009)PubMedCentralPubMedGoogle Acadêmico
-
62.JA Choi, Kim JY, JY Lee, CM Kang, HJ Kwon, YD Yoo, TW Kim, YS Lee, SJ Lee, Int. J. Oncol. 19 , 837–844 (2001)PubMedGoogle Scholar
-
63PCH Hollman, JMP de Trijp, Buysman de MNCP, MSVD Gaag, MJB Mengelers, JHM de Vries, MB Katan, FEBS Lett. 418 , 152–156 (1997)PubMedGoogle Scholar
-
64J. Yang, RH Liu, J. Agric. Food Chem. 57 , 8581–8586 (2009)PubMedGoogle Scholar
-
65F. Conforti, G. Ioele, GA Statti, M. Marrelli, G. Ragno, F. Menichini, Food Chem. Toxicol 46 , 3325–3332 (2008)PubMedGoogle Scholar
-
66S. Rice, S. Whitehead, Endocr. Relat. Câncer 13 , 995–1015 (2006)PubMedGoogle Scholar
-
67VM Dembitsky, T. Gloriozova, VV Poroikov, Mini Rev. Med. Chem. 7 , 571–589 (2007)Google Acadêmico
-
68S. Gao, M. Hu, Mini-Rev. Med. Chem. 10 , 550–567 (2010)PubMedCentralPubMedGoogle Acadêmico
-
69M. Solanas, L. Grau, R. Moral, E. Vela, R. Escrich, E. Escrich, Carcinogênese 31 , 871-879 (2010)PubMedGoogle Scholar
-
70A. Vázquez-Martin, R. Colomer, J. Brunet, AC Carrasco-Pancorbo, R. Garcia-Villalba, A. Fernández-Gutierrez, A. Segura-Carretero, BMC Câncer 7 , 713 (2007)Google Acadêmico
-
71Y. Zuo, C. Wang, J. Wen, antioxidante e capacidade de câncer de antibiótico de amora americana e outras frutas, resumos de documentos, 225º Encontro Nacional da ACS (ACS, Nova Orleans, LA, 2003), pp. 23–27Google Scholar
-
72BT Murphy, XJ Yan, C. Gomes, GB Hammond, C. Neto, Elucidação da Estrutura e Isolamento de Agentes Antitumorais de Frutos e Raízes de Arando, Resumos de Documentos, 225º Encontro Nacional da ACS (ACS, New Orleans, LA, 2003), pp 23–27Google Acadêmico
-
73G. Gattuso, D. Barreca, C. Gargiulli, U. Leuzzi, C. Caristi, Molécula 12 , 1641–1673 (2007)Google Acadêmico
-
74FV Assim, N. Guthrie, AF Chambers, M. Moussa, KK Carroll, Nutr. Câncer 26 , 167–181 (1996)PubMedGoogle Scholar
-
75N. Guthrie, KK Caroll, adv. Exp. Med. Biol. 439 , 227–236 (1998)PubMedGoogle Scholar
-
76O. Benavente-Garcia, J. Castillo, J. Agric. Food Chem. 56 , 6185–6205 (2008)PubMedGoogle Scholar
-
77T. Arpornsuwan, T. Punjanon, Phytother. Res. 20 , 515–517 (2006)PubMedGoogle Acadêmico
-
78MY Wang, CJ Jensen, C. Su, Efeitos preventivos da Morinda citrifolia no câncer de mama mamário. Patente dos EUA: 20050037101 (2009)Google Acadêmico
-
79X. Chang, GL Firestone, LF Bjeldanes, Carcinogênese 27 , 541-550 (2006)PubMedGoogle Acadêmico
-
80G. Brandi, GF Schiavano, N. Zaffaroni, C. De Marco, M. Paiardini, B. Cervasi, J. Nutr. 135, 1503–1509 (2005)PubMedGoogle Scholar
-
81YH Ju, KE Carlson, J. Sun, D. Pathak, BS Katzenellenbogen, J. Katzenellenbogen, WG Helferich, J. Agric. Food Chem. 48 , 4628–4634 (2000)PubMedGoogle Scholar
-
82SK Myung, WK Bae, SM Oh, Y. Kim, W. Ju, J. Sung, Y. Lee, J. Ko, Canção JI, HJ Choi, Int. J. Cancer 124 , 670–677 (2009)PubMedGoogle Scholar
-
83M. Sartippour, R. Pietras, DC Marquez-Garban, HW Chen, D. Heber, SM Henning, G. Sartippour, L. Zhang, M. Lu, O. Weinberg, JU Rao, MN Brooks, Carcinogenesis 27 , 2424 - 2433 (2006)PubMedGoogle Acadêmico
-
84S. Kiitagawa, T. Nabekura, S. Kamiyama, J. Pharm. Pharmacol. 56 , 1001–1005 (2004)Google Acadêmico
-
85T. Luo, J. Wang, Y. Yancun, H. Hua, J. Jing, Jing, X. Sun, M. Li, JY Zhang. Câncer de Mama Res. 12 , R8 (2010)PubMedCentralPubMedGoogle Acadêmico
-
86JR Carlson, BA Bauer, A. Vincent, PJ Limbourg, T. Wilson, Mayo Clin. Proc. 82 , 725–732 (2007)PubMedGoogle Scholar
-
87K. Nakachi, K. Suemasu, K. Suga, T. Takeo, K. Imai, Y. Higashi, Jpn. J. Cancer Res. 89 , 254–261 (1998)PubMedGoogle Scholar
-
88MJ Shrubsole, W. Lu, Z. Chen, XO Shu, Y. Zheng, Q. Dai, Q. Cai, K. Gu, ZX Ruan, YT Gao, W. Zheng, J. Nutr. 139 , 310–316 (2009)PubMedCentralPubMedGoogle Acadêmico
-
89Maneira de TD, Lee de HH, MC Kao, JK Lin, Eur. J. Cancer 40 , 2165–2174 (2004)PubMedGoogle Scholar
-
90BE Mackey, HJ Kim, É Lee, KR Lee, SU Lee, E. Kozukue, N. Kozukue, J. Agric. Food Chem. 55 , 243–253 (2007)PubMedGoogle Scholar
-
91SC Larsson, L. Bergkvist, A. Wolk, Câncer Causas Controle 20 , 2039–2044 (2009)PubMedGoogle Scholar
-
92J. Li, P. Seibold, J. Chang-Claude, D. Flesch-Janys, J. Liu, K. Czene, K. Humphreys, P. Hall, Breast Cancer Res. 13 , R49 (2011)PubMedCentralPubMedGoogle Acadêmico
-
93JM Pezzuto, TP Kondratyuk, E. Shalaev, Carcinog. Anticarcinog. Componente Alimentar. 96 , 239–242 (2006)Google Acadêmico
-
94JM Pezzuto, J. Agric. Food Chem. 56 , 6777–6784 (2008)PubMedGoogle Scholar
-
95J. Yang, TE Martinson, RH Liu, Food Chem. 116 , 332–339 (2009)Google Acadêmico
-
96AP Nifli, M. Kampa, VI Alexaki, G. Notas, E. Castanas, J. Dairy Res. 72 , 44–50 (2005)PubMedGoogle Scholar
-
97.H. Nakagawa, Y. Kiyozuka, Y. Uemura, H. Senzaki, N. Shikata, K. Tanaka, Nyugan Kiso Kenkyu 10 , 62-68 (2001)Google Acadêmico
-
98H. Nakagawa, Y. Kiyozuka, Y. Uemura, H. Senzaki, N. Shikata, K. Hioki, J. Cancer Res. Clin. Oncol. 127 , 258-264 (2001)PubMedGoogle Scholar
-
99F. Hakimuddin, G. Paliyath, K. Meckling, Breast Cancer Res. Tratar. 85 , 65–79 (2004)PubMedGoogle Scholar
-
100F. Hakimuddin, G. Paliyath, K. Meckling, J. Agric. Food Chem. 54 , 7912–7923 (2006)PubMedGoogle Scholar
-
101N. Lu, S. Zhang, Q. Ge, Um remédio para o tratamento do carcinoma de mama, Fama Zhuanli Shenqing Gongkai Shuomingshu Patente CN 1371711 (2002)Google Acadêmico
-
102M Grossmann, NK Mizuno, T. Schuster, MP Cleary, Int. J. Oncol. 36 , 421–426 (2010)PubMedGoogle Scholar
-
103X. Liu, Medicina para tratamento de tumor e câncer e método de preparo do mesmo, Patente Chinesa: CN 101607012 (2009)Google Acadêmico
-
104M. Friedman, CE Levin, SU Lee, HJ Kim, IS Lee, JO Byun, N. Kozukue, J. Agric. Food Chem. 57 , 5727–5733 (2009)PubMedGoogle Scholar
-
105SH Choi, JB Ahn, N. Kozukue, HJ Kim, Y. Nishitani, L. Zhang, M. Mizuno, CE Levin, M. Friedman, J. Agric. Food Chem. 60 , 3891–3899 (2012)PubMedGoogle Scholar
-
106S. Hu, A Cordyceps vinho saúde e método de fabricação de cerveja Kudzu, Patente Chinesa: CN 101693862A (2010)Google Acadêmico
-
107.YT Deng, Huang HC, JK Lin, Mol. Carcinog. 49 , 141–151 (2010)PubMedGoogle Scholar
-
108M. Gosalvez, J. Díaz-Gil, J. Coloma, L. Salganicoff, fr. J. Cancer 36 , 243–253 (1977)PubMedCentralPubMedGoogle Scholar
-
109T. Colman de Saizarbitoria, JE Anderson, D. Alfonso, JL McLaughlin, Acta Cient. Venez. 48 , 42–46 (1997)PubMedGoogle Scholar
-
110.Y. Fujii, Adv. Biomim Ser. 1 , 524–532 (2006)Google Acadêmico
-
111C. Regnault-Roger, BJR Philogene, Pharm. Biol. (Nova York) 46 , 41–51 (2008)Google Acadêmico
-
112J. Gertsch, S. Meier, N. Tschopp, KH Altmann, Chimia 61 , 368-372 (2007)Google Acadêmico
-
113PM Finnegan, KL Soole, AL Umbach, adv. Photosynth. Respir. 17 , 163–230 (2004)Google Acadêmico
-
114M. Salama, O. Arias-Carrion, Ther. Adv. Neurol Desordem. 4 , 361–373 (2011)PubMedCentralPubMedGoogle Acadêmico
-
115NK Singhal, G. Srivastava, S. Agrawal, SK Jain, MP Singh, Mol. Neurobiol. 45 , 186–199 (2012)PubMedGoogle Scholar
-
116R. Nistico, B. Mehdawy, S. Piccirilli, N. Mercuri, Int. J. Immunopathol. Pharmacol. 24 , 313–322 (2011)PubMedGoogle Scholar
-
117AJ Wolpaw, Shimada K., R. Skouta, Welsch ME, Akavia UD, D. Pe'er, Shaik F., J. Chloe Bulinski, BR Stockwell, Proc. Nat. Acad. Sci. EUA 108 , 771–780 (2011)Google Acadêmico