Separação e determinação de ânions em amostra aquosa por eletroforese em microssistema com detecção C4D (ME-C4D)
Sodré Gonçalves de Brito Neto
Núcleo Livre , Universidade Federal de Goiás - UFG, Goiânia/GO, Brasil
PROFESSOR LUCAS MATTOS DUARTE
Introdução
A eletroforese , que é a técnica de segregação de partículas , de solutos em meio líquido, quando sob forte campo elétrico, permite uma série de variações e conjugações que geram diversas possibilidades de segregação e identificação de diversos compostos com custos baixos em relação a muitos outros equipamentos . No atual trabalho identificamos 3 analitos por eletroforese reversa; cloreto, nitrato e acetato.
Materiais e métodos
Equipamento:
Foi usado equipamento ER490 é um sistema para experimentos de eletroforese de microchips. Inclui detecção de condutividade sem contato (C4D). Diferentemente do ER455 , o sistema ER490 possui os eletrodos C4D na plataforma ET121 em vez de no chip, tornando o sistema mais versátil. O sistema inclui dois chips microfluídicos Zeonor ( ET195-2 ); chips com um design semelhante desenvolvido pelo usuário podem ser usados com este sistema. O sistema inclui o software PowerChrom para coleta e análise de dados e o software QuadSequencer para controlar a unidade HVS para experimentos com injeções flutuantes, fechadas ou comprimidas, que foi o que usamos nesta experiência.
O ER490 inclui:
- Detector ER815 C4D com software PowerChrom
- Sequenciador de alta tensão ER430
- Cabos de alta tensão EC230
- Plataforma de microchip ET121 com eletrodos C4D, com dois chips de Zeonor ET195-2
- Soluções de teste padrão EC020
- Braçadeira de fio de chumbo ET067

Microchip
Vários sistemas e variações podem ser adaptadas aos testes por eletroforese https://link.springer.com/protocol/10.1007/978-1-4939-8964-5_13 . No uso de microchips a pesquisa aponta pelo menos 4 delas (simplest, floating, pinched e gated) : 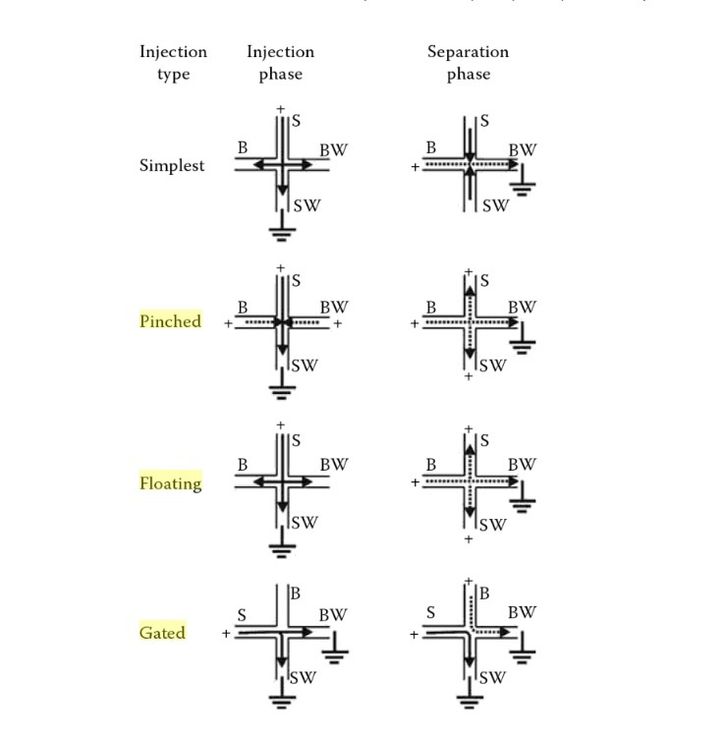
O chip de eletroforese capilar de dolomita Mitos A que separa as espécies em sua proporção de tamanho e carga«Nanotechnology Now - Press Release: Dolomite Microfluidic Glass Chip Separates Biological Molecules. www.nanotech-now.com
«Nanotechnology Now - Press Release: Dolomite Microfluidic Glass Chip Separates Biological Molecules. 
100 mm/L de MES "é o nome comum para o composto ácido 2- ( N- morfolino) etanossulfônico . Sua estrutura química contém um anel de morfolina . Tem um peso molecular de 195,2 e a fórmula química é C 6 H 13 NO 4 S. Os sinônimos incluem: ácido 2-morfolinoetanossulfônico; Ácido 2- (4-morfolino) etanossulfónico; Ácido 2- (N-morfolino) etanossulfónico; Ácido 2- (4-morfolino) etanossulfónico; MES; Hidrato de MES; e hidrato de ácido morfolin-4-etanossulfónico. O MOPS é um composto tampão de pH semelhante que contém uma porção propanossulfônica em vez de uma porção etanossulfônica".[2]
100 mm/L de Histidina "(abreviadamente, His ou H) é um aminoácido essencial. As proteínas são constituídas a partir de 20 aminoácidos padrão, chamados de α-aminoácidos, já que, com exceção da prolina, apresentam um grupo amino primário e um grupo carboxila ligado ao mesmo átomo de carbono".[3]
Amostras
Cloreto, nitrato e acetato.
Estoque CTAB 2 mm/L - "O brometo de cetrimônio ([(C 16 H 33 ) N (CH 3 ) 3 ] Br; brometo de cetiltrimetilamônio; brometo de hexadeciltrimetilamônio; CTAB ) é um surfactante quaternário de amônio .
É um dos componentes da cetrimida anti-séptica tópica . O cátion cetrimonium (hexadeciltrimethylammonium) é um agente anti-séptico eficaz contra bactérias e fungos. É também um dos principais componentes de alguns tampões para a extração de DNA. Tem sido amplamente utilizado na síntese de nanopartículas de ouro ( por exemplo , esferas, bastões, bipiramides), nanopartículas mesoporosas de sílica ( por exemplo,, MCM-41) e produtos de condicionamento de cabelo. Os compostos intimamente relacionados, cloreto de cetrimônio e estearato de cetrimônio, também são usados como anti-sépticos tópicos e podem ser encontrados em muitos produtos domésticos, como xampus e cosméticos. O CTAB, devido ao seu custo relativamente alto, normalmente é usado apenas em cosméticos selecionados.
Como a maioria dos surfactantes, o CTAB forma micelas em soluções aquosas. A 303 K (30 ° C), forma micelas com número de agregação 75-120 (dependendo do método de determinação; média ~ 95) e grau de ionização, α = 0,2–0,1 (carga fracionária; de baixa a alta concentração). A constante de ligação (K °) do contra- Br - a uma micela CTA + a 303 K (30 ° C) é de ca. 400 M-1. Este valor é calculado a partir de medições de eletrodo seletivo de íons Br - e CTA + e dados de condutometria , usando dados da literatura para o tamanho de micelas (r = ~ 3 nm) [ citação necessário ], extrapolado para a concentração crítica de micelas de 1 mM . No entanto, o K ° varia com a concentração total de surfactante, sendo extrapolado até o ponto em que a concentração de micelas é zero".Cetrimonium bromide
Tampão de 30 mm/L de MES, 15 mm/L de Histidina e 0,05 mm/L de CTAB
Injeção de 1 minuto com floating de 1 segundo.
Cálculo da mobilidade
A fórmula básica é L.l/t.v onde L= Distância da injeção até a saída. l= local de detecção . t= tempo. v= voltagem, porém não foi possível calcular devido não ter sido dado tempo de fluxo. Portanto apenas uma mobilidade aparente.
Cálculo de Eficiência
N= 16 (tmi/wi)²
Cáculo de resolução
2(tmb - tma)/wa - wb
Bolha, ruído e o CTBA
Percebemos que o CTBA permite boa mobilidade de fluxo, mas espuma e gera bolhas, o que gera "ruídos" e muitos picos no gráfico, pelo menos no início das injeções, mas tendem a diminuir e gerar estabilidade de fluxo.
Quintuplicata
Em 5 injeções , recomenda-se o referencial médio entre a 2a e a 4a passagem , levando em conta apenas a 2a, 3a e 4a passagem, ignorando a primeira e a última. A diferença entre a primeira e a segunda costuma ser muito grande devido a vários fatores, entre eles, talvez o principal, seja o efeito da tensão no ambiente geral e analitos; o que depois da segunda passagem , tende a estabilizar os valores gerando maiores repetições e aproximações .
Resultados
Sem inverter o fluxo não teríamos resultados relacionados ao acetado devido seu tamanho. Inverteu-se o fluxo mudando os polos negativos com positivos.
Dos sistemas aplicados ao chip foi usado o "flotation" onde se cria na interseção um fluxo que desvia e afunila o fluxo do analito. Desliga 1 segundo o que faz criar uma banda ao centro e depois liga novamente, separando assim parte menor da amostra para que seja detectado com picos mais "finos" referentes ao analitos.
Na trilha maior foi estabelecido potencial de 1800 volts e na menor 1200 volts.
Foi preciso zerar no software QuadSequencer formador do gráfico de detecção para que a linha ficasse reta
Preenchemos as trilhas fininhas do capilar com aparelho manual .
Ligou, estabilizou a linha, zerou sinal no software e depois desligou por 1 segundo a trilha maior de 1800 volts, para gerar a "bolsa" na amostra injetada na trilha menor de 1200 volts, fazendo-a desprender até chegar ao detector . A relação 12200 volts para trilha de menor percurso para 1800 volts de maior percurso foi previamente otimizada por meio de experiências e cáculos aproximados.
Houveram 3 tentativas até que os picos dos analitos apareceram, não tão finos. Houve queda de estrato da linha logo após os picos. E houve uma repetição de imagem a partir principalmente da segunda injeção o que confirmou o sistema de detecção pela repetibilidade.
Conclusões
O sistema funcionou para detecção da presença dos analitos descritos o que permite tipos de testes em outros produtos alegando conter os mesmos.
| Áreas (mV) | Condições instrumentais | ||||||||||
| Pico 1 | Pico 2 | Pico 3 | BGE | MES/HIS 30/15 mmol L-1 e CTAB 0.05 mmol L-1 | |||||||
| Corrida 1 | 10,4 | 10,86 | 6,48 |
Injeção
|
Gated - 1 s / -1400 V (reservatório de amostra) / -2000 V (reservatório BGE)
|
||||||
| Corrida 2 | 4,48 | 4,67 | 2,51 | ||||||||
| Corrida 3 | 3,92 | 3,73 | 2,17 | Detecção | C4D (frequência 1200 kHz / 100%) | ||||||
| Corrida 4 | 3,22 | 3,42 | 1,46 |
Chip
|
Vidro / configuração em duplo-T com gap de 100 μm / L=85 mm e l=78 mm / largura e altura dos canais 100 e 10 μm
|
||||||
| Corrida 5 | 2,74 | 2,78 | 1,41 | ||||||||
|
REALIZAR OS CÁLCULOS COM RELAÇÃO À ANÁLISE COM INVERSÃO DE FLUXO.
|
ANÁLISE COM INVERSÃO DE FLUXO | ||||||||||
|
Observações:
|
|||||||||||
| Grupo 1: Larissa / Ester / Raqueila / Matheus / Sodré |
1) Perceba que no eletroferograma existem 5 injeções sequenciais, cada uma referente as corridas 1, 2, 3, 4 e 5. É importante localizar ponto de injeção para cortar os eletroferogramas e plotá-los individualmente. Por exemplo, na segunda corrida, o sinal da injeção é caracterizado por um pequeno pico (para baixo) no tempo ~3.64 min. Para as
|
||||||||||
|
2) Com relação ao terceiro pico que aparece nos eletroferogramas (um pequeno ao lado do nitrato), é preciso marcá-lo como um possível interferente e tentar justificar o que pode ter ocorrido.
|
|||||||||||
|
Eletroferograma
|
Condições instrumentais | Eletroferograma | Curvas de calibração | ||||||||||||||||||
| 0,00017 | 44 | BGE | MES/HIS 30/15 mmol L-1 | 0,00017 | -99 | Espécie 1 | Espécie 2 | Espécie 3 | |||||||||||||
| 0,00033 | 44 |
Injeção
|
Gated - 1 s / -1400 V (reservatório de amostra) / -2000 V (reservatório BGE)
|
0,00033 | -99 | [1] (μmol L-1) | Área do pico (mV) | [2] (μmol L-1) | Área do pico (mV) | [3] (μmol L-1) | Área do pico (mV) | ||||||||||
| 0,0005 | 44 | 0,0005 | -99 | 50 | 1,68 | 50 | 1,7 | 50 | 1 | ||||||||||||
| 0,00067 | 44 | Detecção | C4D (frequência 1200 kHz / 100%) | 0,00067 | -99 | 50 | 1,64 | 50 | 1,8 | 50 | 1,1 | ||||||||||
| 0,00083 | 44 |
Chip
|
Vidro / configuração em duplo-T com gap de 100 μm / L=85 mm e l=78 mm / largura e altura dos canais 100 e 10 μm
|
0,00083 | -99 | 50 | 1,66 | 50 | 1,8 | 50 | 1,2 | ||||||||||
| 0,001 | 44 | 0,001 | -99 | 75 | 2,64 | 75 | 2,7 | 75 | 1,58 | ||||||||||||
| 0,00117 | 44 | 0,00117 | -99 | 75 | 2,65 | 75 | 2,8 | 75 | 1,58 | ||||||||||||
| 0,00133 | 44 | 0,00133 | -99 | 75 | 2,68 | 75 | 2,9 | 75 | 1,59 | ||||||||||||
| 0,0015 | 44 | ANÁLISE SEM INVERSÃO DE FLUXO | 0,0015 | -99 | 100 | 3,5 | 100 | 3,6 | 100 | 2,2 | |||||||||||
| 0,00167 | 44 | 0,00167 | -99 | 100 | 3,4 | 100 | 3,8 | 100 | 2,1 | ||||||||||||
| 0,00183 | 44 | 0,00183 | -99 | 100 | 3,2 | 100 | 3,7 | 100 | 2,4 | ||||||||||||
| 0,002 | 44 | 0,002 | -99 | 125 | 4,4 | 125 | 4,5 | 125 | 2,6 | ||||||||||||
| 0,00217 | 44 | 0,00217 | -99 | 125 | 4,5 | 125 | 4,7 | 125 | 2,7 | ||||||||||||
| 0,00233 | 44 | 0,00233 | -99 | 125 | 4,3 | 125 | 4,6 | 125 | 2,8 | ||||||||||||
| 0,0025 | 44 | 0,0025 | -99 | 150 | 5,2 | 150 | 5,8 | 150 | 3,1 | ||||||||||||
| 0,00267 | 44 | 0,00267 | -99 | 150 | 5,3 | 150 | 5,8 | 150 | 3,2 | ||||||||||||
| 0,00283 | 44 | 0,00283 | -99 | 150 | 5,4 | 150 | 5,6 | 150 | 3,3 | ||||||||||||
| 0,003 | 44 | 0,003 | -99 | ||||||||||||||||||
| 0,00317 | 44 | 0,00317 | -99 | ||||||||||||||||||
| 0,00333 | 44 | 0,00333 | -99 | ||||||||||||||||||
| 0,0035 | 44 | 0,0035 | -99 | ||||||||||||||||||
| 0,00367 | 44 | 0,00367 | -99 | ||||||||||||||||||
| 0,00383 | 44 | 0,00383 | -99 | ||||||||||||||||||
| 0,004 | 44 | 0,004 | -99 | ||||||||||||||||||
| 0,00417 | 44 | 0,00417 | -99 | ||||||||||||||||||
| 0,00433 | 44 | 0,00433 | -99 | ||||||||||||||||||
| 0,0045 | 44 | 0,0045 | -99 | ||||||||||||||||||
| 0,00467 | 44 | 0,00467 | -99 | ||||||||||||||||||
| 0,00483 | 44 | 0,00483 | -99 | ||||||||||||||||||
| 0,005 | 44 | 0,005 | -99 | ||||||||||||||||||
| 0,00517 | 44 | 0,00517 | -99 | ||||||||||||||||||
| 0,00533 | 44 | 0,00533 | -99 | ||||||||||||||||||
| 0,0055 | 44 | 0,0055 | -99 | ||||||||||||||||||
| 0,00567 | 44 | 0,00567 | -99 | ||||||||||||||||||
| 0,00583 | 44 | 0,00583 | -99 | ||||||||||||||||||
| 0,006 | 44 | 0,006 | -99 | ||||||||||||||||||
| 0,00617 | 44 | 0,00617 | -99 | ||||||||||||||||||
| 0,00633 | 44 | 0,00633 | -99 | ||||||||||||||||||
| 0,0065 | 44 | 0,0065 | -99 | ||||||||||||||||||
| 0,00667 | 44 | 0,00667 | -99 | ||||||||||||||||||
| 0,00683 | 44 | 0,00683 | -99 | ||||||||||||||||||
| 0,007 | 44 | 0,007 | -99 | ||||||||||||||||||
| 0,00717 | 44 | 0,00717 | -99 | ||||||||||||||||||
| 0,00733 | 44 | 0,00733 | -99 | ||||||||||||||||||
| 0,0075 | 44 | 0,0075 | -99 | ||||||||||||||||||
| 0,00767 | 44 | 0,00767 | -99 | ||||||||||||||||||
| 0,00783 | 44 | 0,00783 | -99 | ||||||||||||||||||
| 0,008 | 44 | 0,008 | -99 | ||||||||||||||||||
| 0,00817 | 44 | 0,00817 | -99 | ||||||||||||||||||
| 0,00833 | 44 | 0,00833 | -99 | ||||||||||||||||||
| 0,0085 | 44 | 0,0085 | -99 | ||||||||||||||||||
| 0,00867 | 44 | 0,00867 | -99 | ||||||||||||||||||
| 0,00883 | 44 | 0,00883 | -99 | ||||||||||||||||||
| 0,009 | 44 | 0,009 | -99 | ||||||||||||||||||
| 0,00917 | 44 | 0,00917 | -99 | ||||||||||||||||||
| 0,00933 | 44 | 0,00933 | -99 | ||||||||||||||||||
| 0,0095 | 44 | 0,0095 | -99 | ||||||||||||||||||
| 0,00967 | 44 | 0,00967 | -99 | ||||||||||||||||||
| 0,00983 | 44 | 0,00983 | -99 | ||||||||||||||||||
| 0,01 | 44 | 0,01 | -99 | ||||||||||||||||||
| 0,01017 | 44 | 0,01017 | -99 | ||||||||||||||||||
| 0,01033 | 44 | 0,01033 | -99 | ||||||||||||||||||
| 0,0105 | 44 | 0,0105 | -99 | ||||||||||||||||||
| 0,01067 | 44 | 0,01067 | -99 | ||||||||||||||||||
| 0,01083 | 44 | 0,01083 | -99 | ||||||||||||||||||
| 0,011 | 44 | 0,011 | -99 | ||||||||||||||||||
| 0,01117 | 44 | 0,01117 | -99 | ||||||||||||||||||
| 0,01133 | 44 | 0,01133 | -99 | ||||||||||||||||||
| 0,0115 | 44 | 0,0115 | -99 | ||||||||||||||||||
| 0,01167 | 44 | 0,01167 | -99 | ||||||||||||||||||
| 0,01183 | 44 | 0,01183 | -99 | ||||||||||||||||||
| 0,012 | 44 | 0,012 | -99 | ||||||||||||||||||
| 0,01217 | 44 | 0,01217 | -99 | ||||||||||||||||||
| 0,01233 | 44 | 0,01233 | -99 | ||||||||||||||||||
| 0,0125 | 44 | 0,0125 | -99 | ||||||||||||||||||
| 0,01267 | 44 | 0,01267 | -99 | ||||||||||||||||||
| 0,01283 | 44 | 0,01283 | -99 | ||||||||||||||||||
| 0,013 | 44 | 0,013 | -99 | ||||||||||||||||||
| 0,01317 | 44 | 0,01317 | -99 | ||||||||||||||||||
| 0,01333 | 44 | 0,01333 | -99 | ||||||||||||||||||
| 0,0135 | 44 | 0,0135 | -99 | ||||||||||||||||||
| 0,01367 | 44 | 0,01367 | -99 | ||||||||||||||||||
| 0,01383 | 44 | 0,01383 | -99 | ||||||||||||||||||
| 0,014 | 44 | 0,014 | -99 | ||||||||||||||||||
| 0,01417 | 44 | 0,01417 | -99 | ||||||||||||||||||
| 0,01433 | 44 | 0,01433 | -99 | ||||||||||||||||||
| 0,0145 | 44 | 0,0145 | -99 | ||||||||||||||||||
| 0,01467 | 44 | 0,01467 | -99 | ||||||||||||||||||
| 0,01483 | 44 | 0,01483 | -99 | ||||||||||||||||||
| 0,015 | 44 | 0,015 | -99 | ||||||||||||||||||
| 0,01517 | 44 | 0,01517 | -99 | ||||||||||||||||||
| 0,01533 | 44 | 0,01533 | -99 | ||||||||||||||||||
| 0,0155 | 44 | 0,0155 | -99 | ||||||||||||||||||
| 0,01567 | 44 | 0,01567 | -99 | ||||||||||||||||||
| 0,01583 | 44 | 0,01583 | -99 | ||||||||||||||||||
| 0,016 | 44 | 0,016 | -99 | ||||||||||||||||||
| 0,01617 | 44 | 0,01617 | -99 | ||||||||||||||||||
Separação e Determinação de Ânions em Amostra Aquosa por Eletroforese em Microssistema com Detecção C4D (ME-C 4D)
Sodré Gonçalves de Brito Neto
Núcleo Livre , Universidade Federal de Goiás - UFG, Goiânia/GO, Brasil
Resumo: Fizemos uma experiência laboratorial de eletroforese invertida usando microchip de vidro para detecção de cloreto de sódio, nitrato de sódio e acetato de sódio no laboratório de eletroforese da UFG. Depois de 3 tentativas conseguimos verificar os picos se repetintindo em 5 passagens, das quais ignoramos a primeira e a última para distinguir uma média dos valores obtidos. A inversão dos polos e a inserção de CTAB que modificou a polaridade da parede do capilar , tornando-a positiva, o que foi necessária para detectar o acetato devido sua mobilidade no sistema normal não permitir detecção.
A eletroforese é a técnica de segregação de partículas , de solutos em meio líquido, quando sob forte campo elétrico, que permite uma série de variações e conjugações que geram diversas possibilidades de segregação e identificação de diversos compostos. Comparando a técnica a outros métodos, esta apresenta muitas vantagens como custos baixos, adaptabilidade e flexibilidade, menor gasto de amostra entre outros . A tecnologia de eletroforese se aprofundou e vem se tornando cada vez mais eficiente, onde destacamos os microchips com seus microcanais construídos em quartzo, vidro ou plástico (dimetilsiloxano) (PDMS), policarbonato (PC), poli (metilmetacrilato) (PMMA), polyester-tonner, os quais permitem análise de diversas amostras, misturas, reação química, pré-tratamento, separação de forma cada vez mais eficiente e rápida. No atual trabalho identificamos 3 analitos por eletroforese reversa; cloreto, nitrato e acetato.
Foi usado equipamento ER490 é um sistema para experimentos de eletroforese de microchips. Inclui detecção de condutividade sem contato (C4D). Diferentemente do ER455 , o sistema ER490 possui os eletrodos C4D na plataforma ET121 em vez de no chip, tornando o sistema mais versátil. O sistema inclui dois chips microfluídicos Zeonor ( ET195-2 ); chips com um design semelhante desenvolvido pelo usuário podem ser usados com este sistema. O sistema inclui o software PowerChrom para coleta e análise de dados e o software QuadSequencer para controlar a unidade HVS para experimentos com injeções flutuantes, fechadas ou comprimidas, que foi o que usamos nesta experiência.
Detector ER815 C4D com software PowerChrom
Sequenciador de alta tensão ER430
Plataforma de microchip ET121 com eletrodos C4D, com dois chips de Zeonor ET195-2
Soluções de teste padrão EC020
Braçadeira de fio de chumbo ET067
Miniaturização e eletroforese em microchips
Os sistemas menores demonstram permitir maior definição nos picos e apresentam uma série de vantagens, incluindo a rapidez.
Vários sistemas e variações podem ser adaptadas aos testes por eletroforese [1]. No uso de microchips a pesquisa aponta pelo menos 4 delas (simplest, floating, pinched e gated).
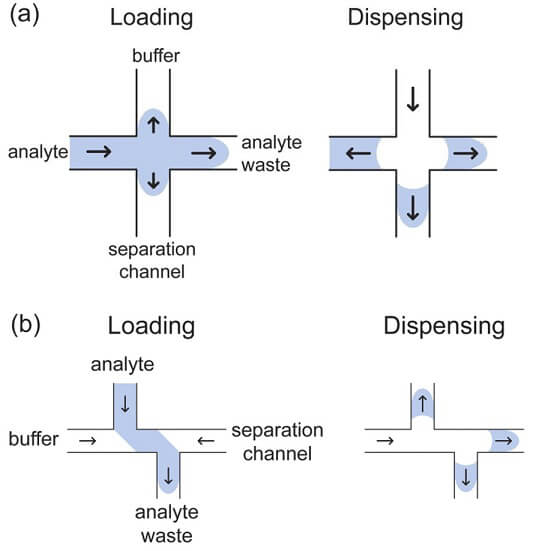
Dos sistemas aplicados ao chip foi usado o "gated" onde se cria na interseção um fluxo que desvia e afunila o fluxo do analito. Desliga a fonte do fluxo (no caso de 1800v) por 1 segundo, o que faz criar um excesso na interceção, e a banda criada ao centropara que quando ligar o fluxo novamente, se desloque parte da amostra para o fluxo, separando assim parte menor da amostra para que seja detectado com picos mais "finos" referentes ao analitos. O chip de eletroforese capilar Mitos separa as espécies em sua proporção de tamanho e carga[2] tração crítica de micelas de 1 mM . No entanto, o K ° varia com a concentração total de surfactante, sendo extrapolado até o ponto em que a concentração de micelas é zero".
Fluxo Eletroosmótico (EOF) ou Eletroforese Capilar (CE)
Tampão de 30 mm/L de MES, 15 mm/L de Histidina e 0,05 mm/L de CTAB, Injeção de 1 minuto, que teve como resultados a mudança do capilar de negativo para positivo, o que associado a mudança dos polos fez inverter o fluxo, pois sem inverter o fluxo não teríamos resultados relacionados ao acetado devido seu tamanho e mobilidade.
100 mm/L de MES "é o nome comum para o composto ácido 2- ( N- morfolino) etanossulfônico . Sua estrutura química contém um anel de morfolina . Tem um peso molecular de 195,2 e a fórmula química é C 6 H 13 NO 4 S. Os sinônimos incluem: ácido 2-morfolinoetanossulfônico; Ácido 2- (4-morfolino) etanossulfónico; Ácido 2- (N-morfolino) etanossulfónico; Ácido 2- (4-morfolino) etanossulfónico; MES; Hidrato de MES; e hidrato de ácido morfolin-4-etanossulfónico. O MOPS é um composto tampão de pH semelhante que contém uma porção propanossulfônica em vez de uma porção etanossulfônica".[3] 100 mm/L de Histidina "(abreviadamente, His ou H) é um aminoácido essencial. As proteínas são constituídas a partir de 20 aminoácidos padrão, chamados de α-aminoácidos, já que, com exceção da prolina, apresentam um grupo amino primário e um grupo carboxila ligado ao mesmo átomo de carbono".[4] cloreto, nitrato e acetato. Estoque CTAB 2 mm/L - "O brometo de cetrimônio ([(C 16 H 33 ) N (CH 3 ) 3 ] Br; brometo de cetiltrimetilamônio; brometo de hexadeciltrimetilamônio; CTAB ) é um surfactante quaternário de amônio . É um dos componentes da cetrimida anti-séptica tópica . O cátion cetrimonium (hexadeciltrimethylammonium) é um agente anti-séptico eficaz contra bactérias e fungos. É também um dos principais componentes de alguns tampões para a extração de DNA. Tem sido amplamente utilizado na síntese de nanopartículas de ouro ( por exemplo , esferas, bastões, bipiramides), nanopartículas mesoporosas de sílica ( por exemplo,, MCM-41) e produtos de condicionamento de cabelo. Os compostos intimamente relacionados, cloreto de cetrimônio e estearato de cetrimônio, também são usados como anti-sépticos tópicos e podem ser encontrados em muitos produtos domésticos, como xampus e cosméticos. O CTAB, devido ao seu custo relativamente alto, normalmente é usado apenas em cosméticos selecionados. Como a maioria dos surfactantes, o CTAB forma micelas em soluções aquosas. A 303 K (30 ° C), forma micelas com número de agregação 75-120 (dependendo do método de determinação; média ~ 95) e grau de ionização, α = 0,2–0,1 (carga fracionária; de baixa a alta concentração). A constante de ligação (K °) do contra- Br - a uma micela CTA + a 303 K (30 ° C) é de ca. 400 M-1. Este valor é calculado a partir de medições de eletrodo seletivo de íons Br - e CTA + e dados de condutometria , usando dados da literatura para o tamanho de micelas (r = ~ 3 nm) extrapolado para a concentração .
3) Análise de ânions;
Este trabalho teve como objetivo, a determinação e a separação de ânions em meio aquoso por meio de eletroforese em microchips, com detecção C4D (ME-C4D). A separação de ânions por eletroforese capilar foi conduzia em soluções aquosas de eletrólitos contendo MÊS (ácido-2-(N-morfolino)entanosulfonico monohidratado ) e Histidina (30/15 mmol.L-1), foi adicionado também uma solução 0,05 mmol.L-1 de CTAB (Brometo de Cetrimônio) que modifica a superfície capilar, assim invertendo o fluxo eletroosmótico e diminuindo o tempo de análise. As amostras estoque, foram soluções aquosas de Cloreto de sódio, Nitrato de sódio e Acetato de sódio, todos com concentração de 10mmol.L-1.
Conclusões
A inversão de fluxo permitiu detectar o acetato que com fluxo normal (+-) não foi possível.
Materiais e métodos
As amostras estoque foram diluídas para que ficassem com a concentração de 100 umol.L-1, para que fosse feito as análises no microchip.
Sistema comercial de eletroforese em microssistema (marca eDAQ), constituído de uma plataforma microfluídica, uma fonte de alta tensão, um detector C4D e um sistema de aquisição de dados. O microchip utilizado foi de vidro, configuração em duplo T com gap de 100 µm com comprimento total de 85mm e comprimento efetivo de 78mm, os canais possuem de largura e altura 100 e 10 µm . Foi utilizada a injeção no modo Gated - 1 s / -1400 V (reservatório de amostra) / -2000 V (reservatório BGE), com detecção C4D (frequência 1200 kHz / 100%).
Foram feitas 3 analises da mesma amostra, para que pudesse obter as médias, e o desvio padrão para a confecção da curva de calibração utilizando o software excel, assim sendo possível determinar sua concentração e a margem de erro das mesmas.
Resultado e discussão
Depois de estabelecermos o fluxo invertido mundando os polos e acrescentando 0,05 mmol.L-1 de CTAB que mudou a polaridade da parede do capilar , invertendo os polos do fluxo (1800 v), o acetato da amostra, foi detectado .
Os cálculos das mobilidades foram feitos utilizando as seguintes expressões:
µap= mobilidade aparente= é dada pelo produto dos comprimentos efetivo mais total dividido pelo tempo de migração do análito pelo potencial aplicado.
µeo= mobilidade eletrosmotica= é dada pelo produto dos comprimentos efetivo mais total dividido pelo tempo de migração do EOF pelo potencial aplicado.
µap= µeo + µep mobilidade eletroforética.
Mobilidades aparente de cada analito foi: Cloreto= 7,68x10-3 cm2.v-1.s-1 ; Nitrato= 7,56x10-3 cm2.v-1.s-1; Acetato= 6,99x10-3 cm2.v-1.s-1. As mobilidades eletroforéticas de cada analito foi: 1,23x10-3 cm2.v-1.s-1 ; Nitrato= 1,35x10-3 cm2.v-1.s-1; Acetato= 1,92x10-3 cm2.v-1.s-1 Mobilidade eletroosmótica é: 8,91x10-3 cm2.v-1.s-1.
Os cálculos de eficiência foram feitos utilizando as seguintes expressões:
N= Eficiência= é dada pelo tempo de migração dividido pela largura do pico ao quadrado.
As eficiências de cada analito foi: Cloreto = 235.548,44 pratos teóricos; Nitrato = 176.880,32 pratos teóricos; Acetato = 101.633,14 pratos teóricos.
Determinação dos ânions: após todas as analises, foi feita a curva de calibração para a determinação da concentração de cada ânion. Figura 1: ânion cloreto, a equação da reta linear é dada pela equação y = 0,0361x - 0,1327, onde a partir desta equação foi determinado a concentração do ânion analisado igual a 84 µmol.L-1 +_ 0,2513 µmol.L-1. Figura 2: ânion nitrato, a reta linear é dada pela equação y = 0,0389x - 0,1733, onde a partir desta equação foi determinado a concentração do ânion analisado igual a 96,4 µmol.L-+_ 0,29051 µmol.L-1. Figura 3: ânion acetato, a reta linear é dada pela equação y = 0,0213x + 0,0367, onde a partir desta equação foi determinado a concentração de ânion analisado igual a 78,38 µmol.L-1 +_ 6,8x10 -6 µmol.L-1. Tabela 1: dados referentes a área dos picos e tempo de migração de cada analito.
|
|
|
Área dos picos |
|
|
Analises |
Pico 1 |
Pico 2 |
Pico 3 |
|
1 |
3,58 |
4,55 |
1,66 |
|
2 |
2,99 |
3,73 |
1,73 |
|
3 |
2,13 |
2,48 |
1,51 |
|
Média |
2,9 |
3,5866 |
1,6333 |
|
D. Padrão |
0,729 |
1,042 |
0,1123 |
|
T. de Migração (s) |
7,28 |
7,36 |
7,96 |
Tabela 1: Pico 1: ânion cloreto; Pico 2: ânion nitrato; Pico 3; ânion acetato.
Concentração µmol.L-1
Concentração µmol.L-1
Figura 1: curva de calibração do ânion cloreto Figura 2: curva de calibração do ânion nitrato
Figura 3: curva de calibração do ânion acetato.
Referências
1. Tavares, Marina Franco Maggi; Carrilho, Emanuel; Coltro, Wendell Karlos Tomazelli; Silva, José Alberto Fracassi da (2007). «Terminologia para as técnicas analíticas de eletromigração em capilares». Química Nova. 30 (3): 740–744. ISSN 0100-4042. doi:10.1590/S0100-40422007000300040
«DeCS Server - List Exact Term». decs.bvs.br. Consultado em 12 de setembro de 2019
2. «Eletrosmose». Wikipédia, a enciclopédia livre. 26 de maio de 2009
3. Gomez, Federico J. V.; Silva, María Fernanda (2019). Dutta, Debashis, ed. «Microchip Electrophoresis Tools for the Analysis of Small Molecules». New York, NY: Springer New York. Methods in Molecular Biology (em inglês): 197–206. ISBN 9781493989645. doi:10.1007/978-1-4939-8964-5_13
4. Fu, Lung-Ming; Tsai, Chien-Hsiung (2008). Li, Dongqing, ed. «Electrokinetic Sample Injection». Boston, MA: Springer US (em inglês): 529–536. ISBN 9780387489988. doi:10.1007/978-0-387-48998-8_429
5. «Nanotechnology Now - Press Release: Dolomite Microfluidic Glass Chip Separates Biological Molecules». www.nanotech-now.com (em inglês). Consultado em 31 de outubro de 2019
6. «MES (buffer)». Wikipedia (em inglês). 12 de julho de 2019
7. «Histidina». Wikipédia, a enciclopédia livre. 7 de abril de 2019
Apêndice
Mobilidade aparente
µap cloreto = = 7,68x10-3 cm2.v-1.s-1
µap nitrato = = 7,56x10-3 cm2.v-1.s-1
µap acetato= = 6,99x10-3 cm2.v-1.s-1
Mobilidade eletroosmotica
µap EOF= = 8,91x10-3 cm2.v-1.s-1
Mobilidade eletroforetica
µap= µeo + µep
µep= - µap + µeo
µep cloreto = - 7,68x10-3 + 8,91x10-3 = 1,23x10-3 cm2.v-1.s-1
µep nitrato=- 7,56x10-3 + 8,91x10-3 = 1,35x10-3 cm2.v-1.s-1
µep acetate= - 6,99x10-3 + 8,91x10-3 = 1,92x10-3 cm2.v-1.s-1
Eficiência
N cloreto = = 235.548,44 pratos teóricos;
N nitrato = = 176.880,32 pratos teóricos;
N acetato = = 101.633,14 pratos teóricos.
Determinação das concentrações de cada ânion analisado
Ânion cloreto: y = 0,0361x - 0,1327 onde y= área do pico; x= concentração a ser encontrada.
X= 2,9+ 0,1327/0,0361 x= 84,00 µmol.L-1
Ânion nitrato: y = 0,0389x - 0,1733 onde y= área do pico; x= concentração a ser encontrada.
X= 3,58 + 0,1733/0,0389 x= 96,40 µmol.L-1
Ânion nitrato: y = 0,0213x + 0,0367 onde y= área do pico; x= concentração a ser encontrada.
X= 16333+ 0,0367/0,0213 x= 78,38 µmol.L-1
Desvio padrão relativo = S/ média x 100
|
|
Pico 1 cloreto |
Pico 2 nitrato |
Pico 3 acetato |
|
Média |
2,9 |
3,5866 |
1,6333 |
|
D. Padrão |
0,729 |
1,042 |
0,1123 |
Desvio P. R. cloreto= (0,729/2,9)x100 = 0,2513 µmol.L-1
Desvio P. R. nitrato = (1,042/3,5866)x100 = 0,2905 µmol.L-1
Desvio P. R. acetato = (0,1123/1,6333)x100 = 6,8x10 -4 µmol.L-1
Referências (ABNT)
-
«Nanotechnology Now - Press Release: Dolomite Microfluidic Glass Chip Separates Biological Molecules». www.nanotech-now.com (em inglês). Consultado em 31 de outubro de 2019
-
«Cetrimonium bromide». Wikipedia (em inglês). 26 de setembro de 2019
-
«MES (buffer)». Wikipedia (em inglês). 12 de julho de 2019
-
«Histidina». Wikipédia, a enciclopédia livre. 7 de abril de 2019