"Quase um século após o reconhecimento do significado do sistema de complemento humano, percebemos que suas funções se estendem muito além da eliminação de micróbios. O complemento atua como um sistema de vigilância imunológica rápido e eficiente que tem efeitos distintos sobre células hospedeiras saudáveis e alteradas e intrusos estrangeiros. Ao eliminar detritos celulares e micróbios infecciosos, orquestrar respostas imunológicas e enviar sinais de "perigo", o complemento contribui substancialmente para a homeostase, mas também pode tomar medidas contra células saudáveis se não for controlado adequadamente. Esta revisão descreve nossa visão atualizada da função, estrutura e dinâmica da rede do complemento, destaca sua interconexão com a imunidade em geral e com outras vias endógenas, e ilustra seus múltiplos papéis na homeostase e na doença". https://www.nature.com/articles/ni.1923
O complemento está centralmente envolvido na imunidade e inflamação através de efeitos diretos sobre as células do sistema imunológico ou via crosstalk e regulação do receptor Toll-like e outras vias (Hajishengallis e Lambris, 2010). Embora um componente importante do hospedeiro imunovigilância , complemento torna-se uma ligação importante entre a infecção e patologia inflamatória quando superativada ou desregulada (Ricklin et al., 2010,Zipfel e Skerka, 2009 ). O desencadeamento do complemento ocorre através de mecanismos distintos em cascata (clássica, lectina, ou alternativa) que convergem no terceiro componente do complemento (C3) e levam à geração de moléculas efetoras que medeiam o recrutamento e ativação de células inflamatórias (via anafilatoxinas C3a e C5a),opsonizaçãomicrobianae fagocitose (via opsoninas como C3be iC3b) elisediretademicróbios-alvo(através do complexo de ataque à membrana C5b-9) (Ricklin et al., 2010). https://www.sciencedirect.com/science/article/pii/S193131281100299X
Deficiencias do sistema complemento
Já foram descritos casos déficits do complemento para quase todos os componentes desse sistema. Normalmente esses indivíduos sofrem infecções freqüentes e/ou enfermidades associadas a imunocomplexos. O déficit se transmite com caráter autossômico recessivo. Os indivíduos heterozigóticos são fáceis de identificar porque seu soro contém aproximadamente metade dos níveis normais do componente em questão. A única exceção a este modelo é o déficit de C1-Inh, que é herdado por um modelo autossômico dominante. Em geral, a situação clínica dos pacientes com déficits genéticos do complemento reflete o papel biológico e a importância de seus distintos componentes in vivo. Surpreendentemente, alguns indivíduos toleram os déficits de complemento muito melhor que outros.
A via clássica é necessária para manter os imunocomplexos em solução e facilitar sua eliminação. Disto, a manifestação mais comum nos déficits dos componentes da via clássica é a presença de enfermidades associadas a imunocomplexos. A importância da via alternativa como mecanismo de defesa inespecífico do organismo contra a infecção por microorganismos reflete o caráter excepcional do déficit destes componentes. Não existe nenhum indivíduo com déficit de fator B e só se conhece um com déficit parcial de fator D (FARRERAS). O déficit de properdina é herdado de forma recessiva ao cromossomo X, só ocorrendo em homens. Sua maior aplicação clínica consiste nas infecções freqüentes.
O déficit na fase lítica provoca infecções recorrentes por Neisseria, seguramente pela capacidade deste micro-organismo sobreviver ao sistema imune como parasita intracelular em macrófagos.
O déficit dos componentes reguladores é raro e leva ao consumo dos componentes do complemento. No déficit que determina o consumo de C3 os pacientes sofrem infecções bacterianas repetidas por ausência de opsonização.
Existem duas situações patológicas, a glomerulonefrite mesangiocapilar e a lipodistrofia parcial, nas quais existe uma grande estabilização das C3-convertases, devido a produção de anticorpos frente aos componentes ativados dessas convertases. Tais autoanticorpos ou fatores nefríticos só podem ser da classe IgG. A estabilização das C3-convertases produzem um consumo continuado de C3, pelo que estes pacientes possuem níveis muito baixos desse componente.
Tabela sobre Deficiências do Complemento
| Componente | Sintomatologia |
|---|---|
| Via Clássica | |
| C1q | Enfermidades por imunocomplexos, infecções repetidas |
| C1r | LES, glomerulonefrite, infecções repetidas |
| C1s | LES (Lúpus eritematoso sistemático) |
| C4a | Enfermidades por imunocomplexos, infecções repetidas |
| C4b | Infecções repetidas |
| C2 | LES. Mais de 90% assintomático |
| Via Alternativa | |
| Fator D | Infecções repetidas das vias respiratórias |
| Properdina | Meningite |
| C3 | Infecções repetidas, enfermidades por imunocomplexos |
| Fase Lítica | |
| C5 | Infecções repetidas por Neisseria, LES |
| C6 | Infecções repetidas por Neisseria, LES |
| C7 | Infecções repetidas por Neisseria, LES |
| C8 | Infecções repetidas por Neisseria, LES |
| C9 | Assintomático |
| Reguladores | |
| C1-inibidor | Angioedema hereditário. LES. Níveis baixos de C2 e C4 |
| Fator I | Infecções repetidas. Valores baixos de C3 e fator B |
| Fator H | Meningite |
| CR1 | Não-genético. Problemas associados a imunocomplexos |
| CR3 | Infecções repetidas. Déficit de LFA-1 e gp150,95 |
| DAF | Não-genético. Hemoglobinúria paroxística noturna |
Opsonização, em imunologia, é o processo que consiste em fixar opsoninas, e.g. imunoglobulinas, em epítopes do antígeno, permitindo a fagocitose. Opson (ὄψον) é a transliteração de uma palavra grega que significa condimento, tempero, molho, ou seja, algo que facilite a digestão.
MAC
Complexo de ataque à membrana (MAC)
A clivagem de C5 pela C5-convertase produz C5a, que é lançado nas vizinhanças do plasma onde é uma potente anafilatoxina (como C3a) e uma agente quimiotático para neutrófilos; C5b, que serve como uma âncora para a formação de uma única estrutura composta por C6, C7 e C8.
O complexo resultante C5b-6-7-8 guia a polimerização de até 18 moléculas de C9 em um tubo inserido na bicamada lipídica da membrana plasmática. Esse tubo forma um canal permitindo a passagem de íons e pequenas moléculas. Água entra na célula por osmose e a célula sofre lise.
C1-C9
O sistema complemento é composto por proteínas da membrana plasmática e solúveis no sangue, que participam das defesas inatas (natural) e adquiridas (memória) ao opsonizar os patógenos e induzir uma série apropriada de respostas inflamatórias que auxiliam no combate à infecção. Inúmeras dessas proteínas reagem entre si para complemento, como proteases que se ativam por clivagem proteolítica.
Às vezes a interacção dos anticorpos com antígenos é eficiente por si só. Por exemplo:
- Revestindo um vírus ou bactéria prevenindo assim a sua ligação – e invasão – a uma célula hospedeira (anticorpos antipólio)
- Ligando-se a uma toxina (toxina da difteria ou tétano) impedindo assim a entrada da toxina na célula - neutralizando a toxina.
Mas, muitas vezes, a ligação de anticorpos a antigénios não produz função útil a menos que ela possa activar um mecanismo efectivo, seja ele celular ou humoral. O sistema complemento participa nestas funções efectoras.
Denomina-se complemento um complexo sistema multiprotéico com mais de 30 componentes, na sua maioria proteínas plasmáticas, cujas funções principais são a defesa frente às infecções por microorganismos, a eliminação da circulação dos complexos antigénio-anticorpo e alguns dos seus fragmentos actuam como mediadores inflamatórios.
O complemento é um dos mecanismos efectores mais importantes da resposta imune inata. Quando um microorganismo penetra no organismo, normalmente provoca a activação do complemento. Como resultado da sua activação e amplificação, alguns componentes do complemento depositam-se sobre a superfície do patogénico responsável pela activação, o que determina a sua destruição (lise) e/ou a sua eliminação por células do sistema fagocítico.
Para que o sistema complemento expresse a sua atividade é necessária a sua ativação prévia. As actividades mais importantes de defesa do hospedeiro são efectuadas por C3 e C5, estruturalmente semelhantes. A clivagem de tais proteínas é feita por proteases altamente específicas, as convertases. Existem três C3 convertases (C4b2a, C3(H20)Bb, C3bBb) e duas C5 convertases (C4b2a3b, C3bBb3b), organizadas durante a activação das três vias do complemento, denominadas vias clássica, da lectina e alternativa.
Uma das funções do sistema complemento é a opsonisação, ou seja, a facilitação para o processo de fagocitose.
Enzimas do sistema complemento:
- C1-esterase;
- C3-convertase
Nessa via a montagem e a organização das convertases são habitualmente iniciadas por anticorpos da classe IgG ou IgM formando complexos com o antígeno. Várias outras substâncias, tais como os complexos da proteína C-reativa (PCR), determinados vírus e bactérias Gram-negativas, também podem ativar esta via. Os ativadores são reconhecidos por serem C1q, uma das três proteínas do complexo C1. Esta ligação ativa C1r que ativa a pró-enzima C1s. Então, C1s ativado cliva C4, resultando na fixação covalente do seu principal fragmento, C4b, à superfície do ativador. O componente C2 liga-se a C4b e é clivado por C1 em dois fragmentos (este processo necessita da intervenção de Ca2+ o Mg2+), dos quais C2a permanece ligado a C4b, completando a montagem do complexo C4bC2a, que é a C3 convertase da via clássica. Esta cliva C3 resultando na ligação de C3b à superfície do ativador e na ligação posterior de C3b à subunidade C4b2a, formando a C4b2a3b que é C5 convertase da via clássica.
Via da lectina
A via da lectina utiliza uma proteína similar a C1q para ativar a cascata do complemento, a lectina ligadora de manose (MBL). A MBL liga-se a resíduos de manose, fucose ou glicose e outros açúcares, organizados em um padrão, que recobrem superficialmente muitos patógenos. A lectina ligadora de manose é uma molécula formada por duas a seis cabeças, semelhante a C1q, que formam um complexo com duas serina proteases a MASP-1 e MASP-2. MASP-2 é similar as proteínas C1r e C1s. Quando o complexo MBL liga-se à superfície de um patógeno, MASP-2 é ativada para clivar C4, em C4a e C4b, e C2 em C2a e C2b, originando a C3 convertase da via da lectina - C4b2b. O papel de MASP-1 ainda não está bem claro na ativação do complemento.
As pessoas deficientes em MBL têm maior suscetibilidade a infecções na infância, o que mostra a importância da via da lectina na defesa do hospedeiro [4]. Esta via participa da resposta imune inata, uma vez que não é mediada por anticorpos.
Via alternativa
Esta via foi denominada alternativa por razões históricas, por ter sido descoberta após a via clássica. A ativação desta via inicia-se a partir da hidrólise espontânea tiol-éster localizada na cadeia alfa do componente C3, gerando o C3(H2O).Esta molécula exibe sítios reativos que permite a ligação de uma proteína plasmática, fator B (fB), formando o complexo C3(H2O)B. O fB então é clivado por uma enzima denominada fator D (fD). Esta clivagem origina 2 fragmentos Ba e Bb. O fragmento Bb fica ligado a C3(H2O), gerando o C3(H2O)Bb, que na presença de íons Mg++, tem atividade serino-protease, clivando o C3 em C3a e C3b. Assim como o C3(H2O), C3b também apresenta sítio de ligação com o fB. Formando o complexo C3bBb, após clivagem do fB em fBb e fBa pelo fD. O C3bBb atua então como C3 convertase, clivando mais moléculas de C3, formando C3bBb3b que cliva C5 em C5a e C5b. O fragmento C5b permanece ligado ao complexo e os outros componentes (C6,C7, C8 e C9)se ligam para a formação MAC. Esta via faz parte da resposta imune inata, uma vez que não é mediada por anticorpos.
Controle da ativação do complemento
A multiplicidade e a potência das atividades biológicas geradas quando o complemento é ativado, e, em particular, a capacidade do complemento de mediar as reações inflamatórias agudas e de produzir lesões letais nas membranas celulares constituem uma ameaça não apenas para os patógenos invasores mas também às células e aos tecidos do hospedeiro. Esse potencial de autolesão da ativação do complemento é normalmente mantido sob controle efetivo por diversos inibidores e inativadores que atuam em pontos de amplificação enzimática, bem como em nível das moléculas efetoras.
O C1 INH liga-se aos C1r, C1s, MASP-1 e MASP-2 ativados e os inibem, regulando assim a ativação da via clássica, bem como da via da lectina. Diversas proteínas no plasma e associadas à membrana, tais como C4bp, H, DAF, MCP e CR1, controlam a taxa de formação e a atividade das convertases do complemento. Algumas dessas proteínas atuam como co-fatores obrigatórios para a enzima proteolítica I, que cliva C4b e C3b em fragmentos menores. Duas proteínas séricas, a proteína S, também denominada vitronectina, e SP 40/40, bem como uma proteína associada a células, CD59, inibem a formação do MAC. Por fim, a C3a/C5a INA, uma carboxipeptidase, inativa as anafilatoxinas do complemento. Em seu conjunto, as proteínas de controle do complemento realizam duas funções importantes: asseguram que a ativação do complemento seja proporcional à concentração e à duração da presença dos ativadores do complemento e protegem as células do hospedeiro contra o potencial deletério dos produtos de ativação do complemento
TNF&
IL 1
IL2 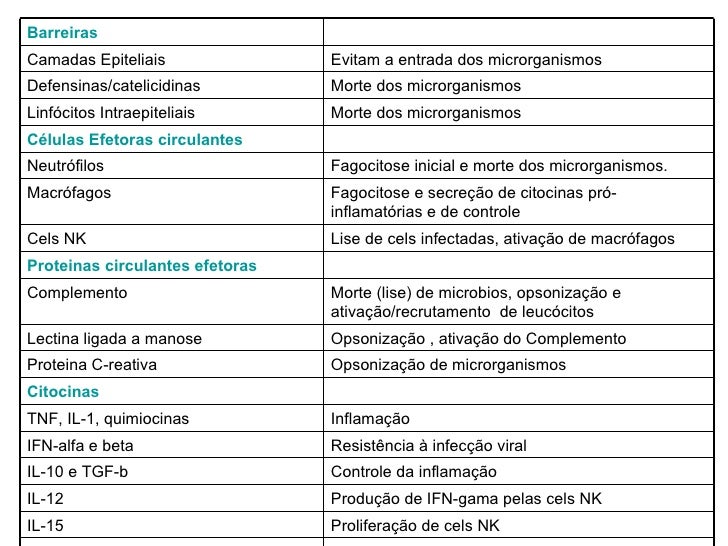
Pamps
Damps 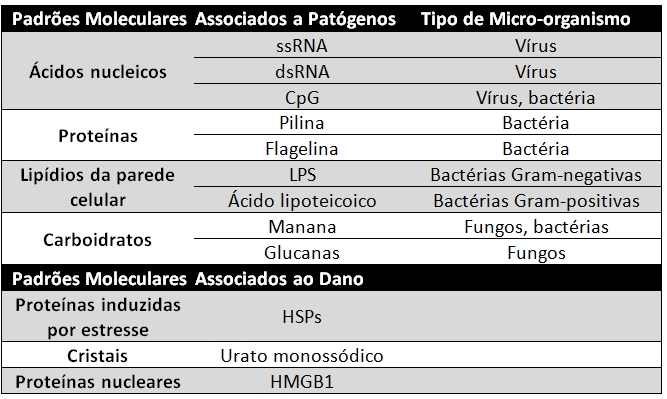
Pamps - exclusiva dos patogenos, compartilhada, receptor compativel PRRs, sobrevivencia patogenicidade e virulencia ,
Damps - moleculas expostas da propria celula , proteina de choque termico , dna mit, citocromo c, etc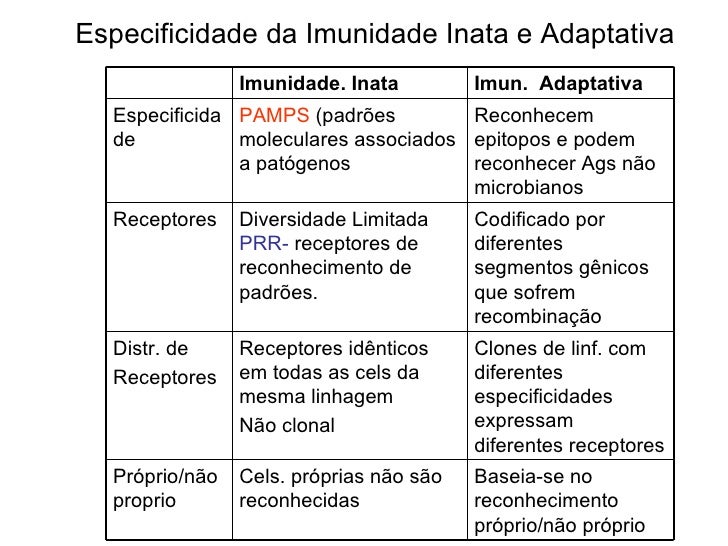
[10:00, 3/4/2019] Sodré: https://www.sciencedirect.com/science/article/pii/S193131281100299X
Porphyromonas gingivalis é uma bactéria anaeróbia oral de baixa abundância implicada na periodontite , uma doença inflamatória polimicrobiana e as condições sistêmicas associadas. No entanto, o mecanismo pelo qual P. gingivaliscontribui para a inflamação e a doença permanece indefinido. Aqui nós mostramos queP. gingivalis , em níveis muito baixos de colonização, desencadeia mudanças na quantidade e composição da microbiota comensal oral, levando à perda óssea periodontal inflamatória . A microbiota e o complemento comensais foram ambos necessários para a perda óssea induzida porP. gingivalis , como camundongos livres de germes.ou camundongos deficientes em receptor C3a e C5a convencionalmente criados não desenvolveram perda óssea após inoculação com P. gingivalis. Estes resultados demonstram que uma única espécie de baixa abundância pode perturbar a homeostase microbiana do hospedeiropara causar doença inflamatória. A identificação e o direcionamento de patógenos similares de baixa abundância com impacto em toda a comunidade podem ser importantes para o tratamento de doenças inflamatórias de etiologia polimicrobiana.
[10:42, 3/4/2019] Sodré: O microbioma modula a função imune do hospedeiro através do trato gastrointestinal , órgãos linfóides periféricos e sistema nervoso central . Nesta revisão, destacamos evidências emergentes de que os efeitos microbianos em fenótipos imunes selecionados surgem no desenvolvimento, onde o microbioma materno e neonatal influencia a ontogenia da célula imune na prole durante a gestação e a vida pós-natal precoce. Discutimos ainda os papéis do microbioma perinatal e da imunidade precocena regulação dos processos normais de neurodesenvolvimento. Além disso, examinamos evidências de que anormalidades nas interações microbio-neuroimunes no início da vida estão associadas a risco alterado de distúrbios neurológicos em humanos. Finalmente, concluímos avaliando as possíveis implicações das intervenções imunológicas da microbiota para condições neurológicas. O progresso contínuo em direção à dissecação de interações mecanicistas entre a microbiota perinatal , o sistema imunológico e o sistema nervoso pode revelar insights fundamentais sobre como as interações de desenvolvimento entre os sistemas fisiológicos informam a saúde e a doença da idade avançada. https://www.sciencedirect.com/science/article/pii/S1074761318305247
[10:43, 3/4/2019] Sodré: https://www.cell.com/immunity/fulltext/S1074-7613(18)30524-7?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1074761318305247%3Fshowall%3Dtrue
