
Controle da LLA e outras por Aférese Terapêutica permitindo Tempo para oncogenômica de precisão e outras abordagens sem risco de vida
Sodré Neto
(Dedicado a uma moça muito especial com LLA recebendo os terríveis MTX, Aracytin) 
RESUMO
Diante de percentuais baixos de sobrevida à maioria dos tratamentos quimioterápicos de caráter agressivo generalista e não específico , propomos aqui a utilização da AT - aférese terapêutica (já recomendada para gestantes com LLA) permitindo tempo para pesquisa e estudos que buscam alternativas menos invasivas e mais específicas para o tratamento de LLA.
O PROBLEMA
As pesquisas avançam e as doenças auto-imunes possuem multifatores causais , muitos deles desconhecidos e ainda não distintos especificamente; recentemente temos um caso de excesso de proteína produzida onde um inibidor da mesma trouxe uma mediana solução,
https://www.estadao.com.br/noticias/geral,depois-de-vencer-tres-vezes-a-leucemia-pesquisador-estuda-doenca,906561
http://www.sciencemag.org/news/2017/07/stem-cell-transplant-helped-beat-back-young-doctor-s-cancer-now-it-s-assaulting-his
https://www.ncbi.nlm.nih.gov/pubmed/29610395
https://www.ncbi.nlm.nih.gov/pubmed/28597939
Uma série de abordagens de menor invasibilidade, incluindo tratamento com nutracêuticos, genômicos, e até abordagens psicológicas e psiquiátricas, etc.. poderiam ser feitos enquanto o sistema de aférese terapêutica controlasse a doença não colocando em risco a vida do paciente, seja pela doença, e muito mais pelo ameaçador corredor da morte que representa a agressividade da maioria das quimioterapias atuais. https://www.ncbi.nlm.nih.gov/pubmed/15630849 (*** artigo citado por mais de 246 artigos relacionados que denunciou em 2004 a ineficiência de 98% das quimioterapias)
Na imensa lista de venenos quimioterápicos, encontramos na própria bula a citação de muitos casos de morte como se fosse um efeito colateral que deveríamos considerar "comum" . O que nos faz pensar que, em face de podermos controlar a LLA e LMC com AT, e a maioria dos cânceres com moduladores da resposta inflamatória e antiangiogênicos, que podemos considerar muito mais do que total irresponsabilidade com a vida do paciente , mas crime e assassinato bem pago mesmo. Um verdadeiro genocídio se pratica hoje e não nos resta nenhuma dúvida que um bom percentual dos assassinos o fazem na melhor das intensões.
Quando se admite por exemplo que :
"Infecções e Infestações: Muito comuns: pneumonia, sepse (infecção grave), infecção (pode ser leve, mas pode ser severa e por vezes fatal). "Devem estar à disposição do paciente os recursos para o tratamento de eventuais complicações, possivelmente fatais, consequentes da supressão da medula óssea (infecção, hemorragia devido à trombocitopenia - diminuição das células de coagulação do sangue: plaquetas)." "Aracytin® CS sozinha ou combinada com outros agentes imunossupressores após doses imunossupressoras que afetem a imunidade celular ou humoral. Essas infecções podem ser leves, mas também podem ser graves e, às vezes, fatais". "Embora tenham nascido crianças normais de pacientes tratadas com Aracytin® CS durante os três trimestres de gravidez, recomenda-se o acompanhamento dessas crianças. " "Terapia com altas doses: após terapia com altas doses de citarabina (2-3 g/m2) relatou-se toxicidade pulmonar, gastrintestinal (do estômago e do intestino) e do sistema nervoso central (cérebro e medula espinhal) grave, diferente daquela observada com os regimes terapêuticos convencionais de citarabina, e por vezes fatal (vide item 8. Quais os males que este medicamento pode me causar?).""Ocorreram casos graves e alguns fatais de toxicidade pulmonar, síndrome da angústia respiratória em adultos (mau funcionamento grave dos pulmões causado por inflamação) e edema pulmonar com esquemas terapêuticos com altas doses de citarabina." Fonte: Bula do Aracytin - http://www.medicinanet.com.br/m/bula/633/aracytin.htm
Veja que se temos medula em quase todos os ossos, suprimir a MO representa atacar praticamente quase todos os ossos da pessoa, apesar que o ataque desejado também passa longe de ser "específico" pois "a medula vermelha é encontrada principalmente nos ossos chatos, como osso do quadril, osso do peito, crânio, costelas, vértebras e omoplatas, e no material esponjoso ("esponjoso") nas extremidades proximais do fêmur e úmero dos ossos longos. Medula rosa é encontrada no interior oco da porção média dos ossos longos. https://www.sciencedaily.com/terms/bone_marrow.htm
Na publicação de 2018 , O Dr. M. A. Rattu, defendeu a utilização de Glucarpidase (Voraxaze), a Carboxypeptidase Enzyme para suportar a toxidade do Methotrexate , antigo fatal veneno necessário no tratamento de LLA, mas que já levou ao óbito milhões de vidas desde seu lançamento em 1950 . Entre as justificativas lemos:
" O regime de tratamento padrão combina LV com alcalinização urinária contínua (com bicarbonato de sódio) e hidratação rigorosa. 8 Infelizmente, mesmo com a função renal de pré-tratamento normal, essa abordagem não reverte a nefrotoxicidade em 2% a 10% dos pacientes. 9 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3875266/
Um quadro assustador de sofrimento e morte em pacientes com LLA, mas que se revela totalmente quase sempre desnecessário (exceto para os altos ganhos com o procedimento e outros procedimentos pagos pelo SUS e sistemas de saúde, decorrentes de suas consequências) se simplesmente usássemos AT- Aférese terapêutica.
Antes de saber da existência de tal recurso , um cientista da UFMG comentou comigo quando sugeri a possibilidade de fazer uma quimioterapia fora do corpo. que no caso da LLA não seria necessária , pois selecionaríamos com "beed magneticc" os linfócitos e bastaria jogá-los fora"... mais tarde raciocinei que devido ao alto custo do sistema nanomagnético, poderíamos simplesmente pegar uma quantidade de leucócitos da pessoa, centrifugar e jogar fora parte das suas células brancas , retornando o sangue para a mesma (***se voltar ozonizado a pessoa ficará muito mais agradecida e em vez de sofrimento sentirá esplêndida melhora bem como tendo a chance de ainda matar células cancerígenas ) .
Teríamos então a diminuição dos linfócitos imaturos de forma mecânica e não quimioterápica com todos os seus riscos, sequelas, sofrimentos e mortes e normalizaríamos o percentual de linfócitos buscando tratar apenas as possíveis causas e procurar ver se existe possibilidade de reparo celular nas sinalizações em falta principalmente nos processos de maturação dos linfócitos.
AFÉRESE TERAPÊUTICA
http://www.hemoterapia9dejulho.com.br/servicos_aferese.asp
https://www.msdmanuals.com/pt-br/profissional/hematologia-e-oncologia/medicina-transfusional/af%C3%A9rese-terap%C3%AAutica
temos a aférese terapeutica que pode controlar o quadro leucemico ...
"A aférese terapêutica consiste na remoção de uma substância ou componente do sangue total de um paciente, através de um equipamento separador de células, específico e automatizado, onde é acoplado um conjunto estéril de bolsas descartáveis.
O componente a ser removido é variável, dependendo do tipo de doença, pode-se remover o plasma, os leucócitos, plaquetas ou os eritrócitos do paciente, conforme tabela abaixo:
|
Tipo
|
Componente removido
|
|
|
Plasmaférese
|
Plasma
|
|
|
Citaférese
|
leucaférese
|
leucócitos
|
|
plaquetaférese
|
plaquetas
|
|
|
eritrocitaférese
|
eritrócitos
|
|
|
linfocitaférese
|
linfócitos
|
|
Indicações
- Plasmaférese Indicada como modalidade terapêutica quando a substância causadora da doença está presente no plasma e pode ser removida através de troca plasmática. A eficácia depende da quantidade de plasma trocado em cada procedimento, da distribuição dessa substância entre os compartimentos intra e extravascular e da velocidade de equilíbrio entre esses compartimentos. O número e o intervalo entre as sessões dependerá da patologia do paciente, da sua velocidade de instalação, da gravidade, da substância alvo a ser removida, assim como da perpetuação do estímulo à produção dessa substância.
- Leucaférese Indicada como terapêutica coadjuvante em algumas patologias hematológicas:
nbsp; Leucemias mielóide agudas com número de blastos no sangue periférico superior a 100.000/mm³.
nbsp; Sinais e /ou sintomas de leucostase, independentemente do número de leucócitos.
nbsp; Controle temporário de leucometria em gestantes portadores de leucemias agudas ou crônicas.
nbsp; Controle da leucometria em patologias resistentes ao tratamento habitual ou em outras situações
em que haja contra-indicação temporária ao uso de drogas quimioterápicas.
- Plaquetaférese Indicada em pacientes com contagem de plaquetas superior a 1.000.000 / mm3, associado a sinais de trombose microvascular ou sangramento excessivo. Plaquetaféreses diárias podem ser necessárias até que haja redução na contagem de plaquetas ou melhora substancial nos sintomas de trombose, enquanto aguarda-se a ação de drogas mielossupressoras.
- Eritrocitaférese Indicada para remoção de eritrócitos, com alteração qualitativa ou quantitativa devido a:
Complicações em pacientes com anemia falciforme: acidente vascular cerebral agudo, síndrome torácica aguda, colestase intra-hepática, priaprismo agudo refratário, preparo pré-operatório.
Infecção por protozoários ( Malária, Babesiose).
Policitemias.
- Linfocitaférese - Alguns estudos mostram diminuição no número de articulações comprometidas em pacientes com artrite reumatóide
submetidos a linfocitaférese terapêutica. É indicada em um número reduzido de pacientes, tendo em vista o custo e a duração limitada dos benefícios atingidos.
- Fotoaférese - Não haverá remoção de componente do sangue, este procedimento consiste na separação dos leucócitos, que são submetidos a irradiação com luz ultravioleta e sua posterior infusão no paciente.
Indicações
Linfoma cutâneo de células T, rejeição aguda e crônica de transplantes de órgãos sólidos.
Como é realizada a Aférese
O médico hemoterapeuta avalia a indicação do procedimento e, juntamente com o médico assistente, programa o número de sessões e intervalo entre elas.
Poderá ser necessária a instalação de um cateter central quando não há veias com calibre adequado ou se existe a previsão de muitas sessões de aférese.
O paciente será conectado a uma máquina separadora, na qual é instalado um conjunto estéril de bolsas e soluções, selecionado de acordo com o componente sanguíneo que deve ser removido/sustituído.
O paciente é monitorizado com cardioscópio e aparelho de pressão arterial, para verificação dos sinais vitais durante a aférese. As alterações hemodinâmicas e/ou sinais e sintomas apresentados pelo paciente são imediatamente avaliadas pelo hemoterapeuta que acompanha o procedimento.
Reações Adversas
Como estes tratamentos são realizados com cuidado e atenção aos detalhes técnicos, a aférese terapêutica é um procedimento seguro. É importante um monitoramento adequado do paciente durante a aférese, com acesso pronto a medicações e equipamentos que permitam o tratamento rápido das possíveis reações.
As reações adversas mais frequentemente descritas são:
nbsp; Hematoma e infiltração de soro no local de punção venosa, para procedimento realizado sem cateter central.
nbsp; Diminuição do cálcio plasmático, ocasionado formigamento e dormência dos lábios e mãos.
nbsp; Reação alérgica ao óxido de etileno, que é a substância utilizada para esterilização do conjunto de bolsas descartáveis.
nbsp; Raramente poderão ocorrer alterações na pressão arterial e alterações do ritmo cardíaco.
O número e a frequência de sessões, bem como a decisão de se interromper ou prolongar o tratamento, será decorrente de uma decisão conjunta entre a equipe médica e a equipe de hemoterapia. A aférese terapêutica é uma medida auxiliar ao tratamento, geralmente aplicada em conjunto com outras modalidades de tratamento, existindo a possibilidade de não haver melhora do quadro clínico."
Agora nos resta estudar se tem algum processo de regeneração da MO (medula óssea)
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0103-84782013000700019&lng=en&nrm=iso&tlng=pt
quitosanas regeneram o tecido ósseo , mas atuariam no DNA da MO ?
http://www.dicasdetreino.com.br/o-que-e-quitosana-para-que-serve/
PLAQUETAS
Podemos centrifugar e separar os leucócitos para preservar as plaquetas antes de retornarmos o sangue ou usar transfusão de plaquetas caso estejam muito baixas https://www.hospitalsiriolibanes.org.br/hospital/Documents/guia-conduta.pdf
A BUROCRACIA ASSASSINA
Ao telefonar para uma das médicas mais respeitadas do Brasil em leucemia, ela prontamente me disse que desconhecia esta técnica e que ela deveria ser encaminhada a pesquisa, uma vez que médico apenas aplica protocolos já pesquisados, testados na fase 1, 2 e 3, com as devidas publicações. As vezes penso que o Dr. Lair Ribeiro ao denunciar que a baixa proporção de médicos no Brasil não tem tempo pra estudar , esteja mais que 99% certo.
Ora, todos nós sabemos a burocracia para se implementar tratamentos baratos que vão sempre para o destino chamado "lata do lixo" como explico neste vídeo, devido não poderem nunca dar retorno financeiro das altas somas que são necessárias para bancar fase clínica, que custa, em caso em média 837 milhões de dólares. 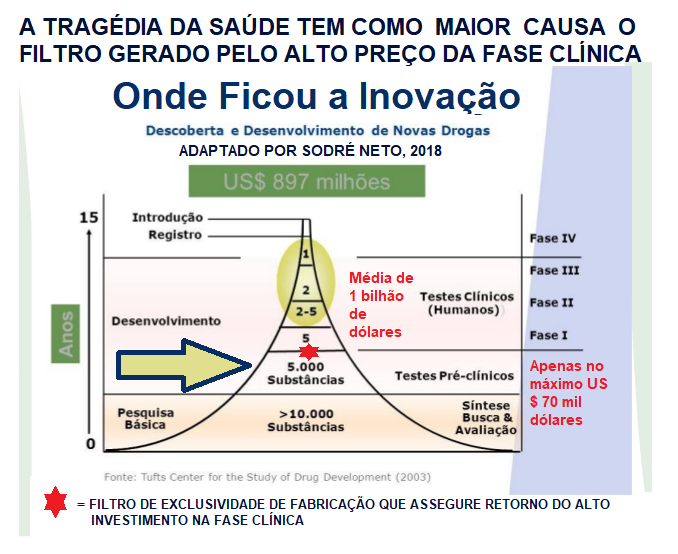
Desta forma , diante do "deus" da verdade cientifica demonstrada , depositamos milhões de crianças para serem sacrificadas, torturadas e mortas, por mais óbvio e mais seguro que demonstra ser este simples protocolo que acredito ter recebido por revelação divina.
ESTUDO DAS LLAs (Leucemia linfoide aguda)
"Uma linfoide aguda é caracterizada por "células leucêmicas (Blastos)" que "apresentam pouco citoplasma com basofilia variada. Bastões de Auer nunca estão presentes e geralmente não são encontrados outras granulações citoplasmática. Três tipos distintos de blastos são encontrados: L1: células pequenas com contorno nuclear regular, sem nucléolos, apresentando pouco citoplasma sem basofilia (Figura 1(5)); L2: células de tamanho diversos cujo citoplasma varia de tamanho e basofilia, podendo apresentar nucléolos e irregularidade de contorno(Figura 2(5)); L3: células grandes com nucléolos, basofilia citoplasmática e vacúolos, este subtipo apresenta imunofenotipo B e é considerado a forma leucêmica do linfócito de Burkitt.(1) (Figura 3(5)). Figura1 - LLA - L1 4 Figura 2: LLA – L2 Fig. 8.32 Leucemia linfoblástica aguda, subtipo L2 células primitivas imaturas que variam consideravelmente de tamanho e quantidade de citoplasma; a proporção nuclear/citoplasma raramente é tão elevada quanto um L1. Os núcleos são variáveis quanto a forma e freqüência contem muitos nucléolos. http://www.ciencianews.com.br/arquivos/ACET/IMAGENS/revista_virtual/hematologia/artapfadel.pdf
Diversos autores têm proposto uma classificação imunológica das LLAs de acordo com a expressão de antígenos específicos http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1676-24442004000200008&lng=en&nrm=iso&tlng=pt 


"Embora a LLA deva sempre ser considerada uma doença grave, a identificação de vários fatores prognósticos permite a estratificação dos pacientes em grupos de risco, o que possibilita uma abordagem terapêutica diferenciada. Os grupos de maior risco são tratados com terapias mais intensas, cada vez mais eficazes, enquanto os grupos de baixo risco apresentam melhor sobrevida, podendo ser poupados dos efeitos deletérios da terapêutica."
FELIX, C. A. et al. Pediatric acute lymphoblastic leukemia: challenges and controversies in 2000. Hematology, p. 285-302, 2000.
PUI, C. H. Childhood leukemias. N Engl J Med, v. 332, n. 24, p. 1618-30, Jun. 15 1995.
SOUZA, J. M.; COELHO, C. J. Leucemias e Leucoses. In: XXV Congresso Brasileiro de Análises Clínicas, 1998, Porto Alegre.
PROPOSTA DE TRATAMENTO
A equipe precisará de um médico e enfermeiro experientes em AT, o oncologista , um laboratorista para verificar e acompanhar a qualidade do sangue ...caso não se disponha da técnica usando AT , nem os beeds magnetics , diminuir-se-á a especificidade, porém retirar os leucócitos proporcionais ao excesso necessário, acredito que será muito menos nocivo que quimioterápicos.
Muitas vezes não será necessário aplicar o quimioterápico muito menos dentro da pessoa, comprometendo sua saúde dos órgãos da pessoa e gerando nela sofrimento. por sistema de hemodiálise pode-se criar tratamentos leucêmicos "fora" da pessoa.
O ideal seria retirar grande parte do sangue e destruir apenas os linfócitos imaturos alvos, mas como esta especifidade completa talvez não seja possível propomos caminhos mais específicos possíveis dentro das possibilidades viáveis .
1. AT ´Aférese terapêutica
2. Método 2, Usando Beed magnetic
Separa-se os linfócitos alvo , examina e os destrói. Os ativos e maduros e com especificidade de ataque, multiplica em soro (pode ser de boi tratado de bacterias e com tampão) com interleucinas 2 e nutrientes.
"bead magnetic" https://www.youtube.com/watch?v=aHsBID5oS4k
http://www.thermofisher.com/br/en/home/life-science/cell-analysis/cell-isolation-and-expansion/cell-isolation/human-cell-isolation-products/human-cd8plus-isolation.html
Kit de Isolamento Positivo Dynabeads® CD8
http://www.thermofisher.com/order/catalog/product/11333D?ICID=cvc-isolation-cd8t-c3t1
3. Método 2 (sem BM)
Retirar-se na sequencia parte do Sangue (XXXXX) , aplica-se quimioterápico, depois faz-se processos de separação de material morto, aplica-se nutrientes (cadeias de aminoácidos), e retorna o sangue para a pessoa
4. Método 3 com equipamento laser ( * Antes de saber da existência da AT eu estava neste artigo propondo a construção de um aparelho semelhante )
Os equipamentos de hemograma são dotados de leitores a laser que distinguem elementos do sangue . Os de hemodiálise fazem a purificação e as vezes nutrição .
Propomos criar um.equipamento.associando capacidade de distinção morfológica , hemodiálise + forma de fazer escapar e eliminar as morfologias indesejadas ou verificadas no exame de sangue serem.cancerígenas .
AUTHOR VERSION Author Version: Published ahead of online first Identification of a novel CPSF6-RARG fusion transcript in acute myeloid leukemia resembling acute promyelocytic leukemia Ya-Zhen Qin, Xiao-Jun Huang, Hong-Hu Zhu Cite this article as: Ya-Zhen Qin, Xiao-Jun Huang and Hong-Hu Zhu, Identification of a novel CPSF6-RARG fusion transcript in acute myeloid leukemia resembling acute promyelocytic leukemia, Leukemia _#####################_ doi:10.1038/s41375-018-0095-z This is a PDF file of an unedited peer-reviewed manuscript that has been accepted for publication. Springer Nature are providing this early version of the manuscript as a service to our customers. The manuscript will undergo copyediting, typesetting and a proof review before it is published in its final form. Please note that during the production process errors may be discovered which could affect the content,and all legal disclaimers apply. Received 28 December 2017; accepted 20 February 2018; Author version _#####################_ © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. Identification of a novel CPSF6-RARG fusion transcript in acute myeloid leukemia resembling acute promyelocytic leukemia Ya-Zhen Qin1 , Xiao-Jun Huang1 , Hong-Hu Zhu1 * 1.Department of Hematology, Peking University People’s Hospital, Peking University Institute of Hematology. *Corresponding author: Hong-Hu Zhu, MD, PhD, Peking University People’s Hospital, Peking University Institute of Hematology, No. 11 Xizhimen South St, Beijing, China; e-mail: zhuhhdoc@163.com. Cleavage and polyadenylation specific factor 6 (CPSF6) is a large subunit of cleavage factor I, which is an RNA binding protein complex that was originally identified as a central player in the alternative cleavage and polyadenylation process.1 The CPSF6 and Nudt21 complex binds RNA and facilitates RNA looping, allowing alternative mRNA 3’ end processing.2 CPSF6 alone controls the key molecular interactions that specify HIV-1 pre-integration complex trafficking to active chromatin.3 Recently, CPSF6 was found to play a vital role in breast cancer aggressiveness.4 However, the role of CPSF6 in leukemia has not been reported so far. Here, we report the first case with a novel CPSF6– retinoic acid receptor gamma (RARG) (CPSF6-RARG) fusion transcript, showing morphological and immunophenotypical features of classical hypergranular acute promyelocytic leukemia (APL). A 38-year-old man was admitted due to oral hemorrhage and skin ecchymosis. His blood count showed a white blood cell count of 1.68×109 /L, © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. including 10% promyelocytes; a hemoglobin level of 80 g/L; and a platelet count of 79×109 /L. His prothrombin time, fibrinogen, fibrin degradation products and D-dimer levels were 14.2 s (ref. 9.4-12.5 s), 115 mg/dl (ref. 200– 400), 235.9 μg/ml (ref. 0-5) and 32513 ng/ml (ref. 0-243), respectively. His activated partial thromboplastin time was within the normal range. A bone marrow (BM) smear showed hypercellularity, with 65% hypergranular promyelocytes (Figure 1a). The BM histochemistry showed the typical pattern of APL (Figure 1b). The leukemia cells expressed myeloperoxidase, CD117, CD123, CD34, CD33 and CD13 and partially expressed CD9 and CD64 but lacked the expression of CD11b, HLA-DR, CD38, CD56, CD14 and other T- or B-lymphoid-related markers. The presumptive diagnosis of this patient was APL. However, both the reverse transcription-polymerase chain reaction (RT-PCR) and fluorescence in situ hybridization (FISH) failed to detect the PML-RARA transcript in the BM. The karyotype analysis revealed 46,XY[20] (Figure 1c). After suspected diagnosis of APL based on the morphological and immunophenotypical findings, we started all-trans retinoic acid (ATRA) treatment at the first day, added an oral arsenic realgar-indigo naturalis formula (RIF) on the fourth day. The percentage of promyelocytes, myelocytes, and metamylocytes in the peripheral blood smear was 4%, 6% and 0% before treatment and was 26%, 32% and 4% after treatment for 14 days, respectively. The white blood cell counts increased from 1.68×109 /L to 4.66×109 /L © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. accordingly. Subsequently, the patient presented unexplained fever, dyspnea, pulmonary infiltrates and pleural effusion by CT scan. Thus the differentiation syndrome was suspected. Because the coagulation abnormalities did not improve after the treatment with ATRA plus arsenic and there was no evidence of RARA rearrangement, ATRA and arsenic were stopped and the induction chemotherapy composed of mitoxantrone and cytarabine was started concomitantly on the 26th day. The patient died on the 37th day because of diffuse alveolar hemorrhage, and we did not perform the BM aspiration to assess the remission. To search for the potential fusion gene, we used the patient’s BM samples collected at diagnosis to perform RNA sequencing using HiSeq (llumina Inc., San Diego, CA, USA). After analyzing the data by STAR-Fusion and adjusting using Fusion Inspector software, the patient was shown to have a novel fusion transcript within chromosome 12, in which CPSF6 was fused to RARG. The Wilms’ tumor (WT1)-R462Q mutation was identified in addition to the CPSF6-RARG fusion by a customized target next-generation sequencing that included 34 acute myeloid leukemia (AML)-related genes. To confirm the fusion, the following pair of primers was designed to perform PCR using cDNA: forward (at CPSF6 exon 4), 5’-cttcatggtcagaatcctgttg-3’ and reverse (at RARG exon 3), 5’-cactgggcctccaaaagtc-3’. An expected band of approximately 200 bp was visualized by electrophoresis, and the PCR product was analyzed by Sanger sequencing. Both the RNA sequencing result and the appearance of © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. background from the fusion site in the sequencing chromatogram suggested that the patient might have more than one type of fusion. The NCBI BLAST website was used, and we found that there were two types of CPSF6-RARG fusion transcripts, which were confirmed by cloning the PCR products into the pGEM-T vector and sequencing 20 clones using a vector-common primer. The major fusion (18/20 clones, 90%, GenBank accession number MG715502) was the fusion of CPSF6 exon 4 (NM_001300947) with RARG exon 2 (NG_029822), and the minor fusion (2/20 clones, 10%, GenBank accession number MG715503) had a 3-bp deletion at the 5’ end of RARG exon 2 compared with the major one (Figure 2a and 2b). As shown in Figure 2c, the fusion was in-frame, and the amino acid of the whole RARG protein was still intact. The BM mononuclear lysates from the patient were analyzed by Western blot with a rabbit anti-RARG antibody (Cell Signaling Technology, Danvers, MA, USA). As shown in Figure 2d, in addition to the wild type band (58 kD), a higher molecular weight band (84 kD) corresponding to the CPSF6 fused RARG was seen, which had 242/243 more amino acids than the wild type. Recently, the two human leukemia cases harboring a rearrangement of RARG, but not RARA, were reported as NUP98-RARG and PML-RARG, and both showed morphologically classic APL.5,6 Compared with PML-RARA, NUP98-RARG and PML-RARG similarly harbor the main functional domains of DNA binding domain (DBD) and ligand-binding domain (LBD) in the fusion © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. protein, which partially explained their similar biological properties. RARG, as well as RARA and RARB, are members of the retinoid acid receptor (RAR) family.7 RARs are nuclear hormone receptors functioning as ligand-activated transcription factors that interact specifically to modulate the transcription of DNA elements.7,8 Previous studies show that heterodimers formed by RXRA-RARG are necessary for growth arrest and visceral and primitive endodermal differentiation.8 The present case with CPSF6-RARG also showed a promyelocytic differentiation block and the morphological and immunophenotypical features of classical hypergranular APL. Therefore, the similar clinical presentation in patients with RARG-rearrangement seems to suggest a novel subtype of AML, which needs more cases and fundamental studies to confirm. How to treat AML patient with CPSF6-RARG is vital because of severe coagulation abnormality and fatal bleeding risk. The patient in this study was lack of an early recovery of coagulopathy after treatment with ATRA and arsenic, which suggested some different characteristics compared to traditional APL. Earlier initiation of chemotherapy and strong support of blood products are necessary to avoid early death. The detailed biological function of CPSF6-RARG needs to be investigated in the future. In conclusion, we describe a novel CPSF6-RARG rearrangement in human leukemia that is morphologically hypergranular APL. The similar clinical characteristics and unfavorable outcome may indicate a novel subtype of AML © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. resembling APL with a RARG rearrangement. CONFLICT OF INTEREST The authors declare no conflicts of interest. ACKNOWLEDGEMENTS Supported by Grants from the National Key R&D Program of China (No. 2016YFE02028 00) and the National Natural Science Foundation of China (No. 81570128, No. 81370639, No. 81570130). Reference 1 Millevoi S, Vagner S. Molecular mechanisms of eukaryotic pre-mRNA 3′ end processing regulation. Nucleic Acids Res 2010; 38: 2757–2774. 2 Yang Q, Coseno M, Gilmartin GM, Doublie S. Crystal structure of a human cleavage factor CFI(m)25/CFI(m)68/RNA complex provides an insight into poly(A) site recognition and RNA looping. Structure 2011; 19: 368–377. 3 Rasheedi S, Shun MC, Serrao E, Sowd GA, Qian J, Hao C, et al. The Cleavage and Polyadenylation Specificity Factor 6 (CPSF6) Subunit of the Capsid-recruited Pre-messenger RNA Cleavage Factor I (CFIm) Complex Mediates HIV-1 Integration into Genes. J Biol Chem 2016; 291: 11809– 11819. 4 Binothman N, Hachim IY, Lebrun JJ, Ali S. CPSF6 is a Clinically Relevant © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. Breast Cancer Vulnerability Target: Role of CPSF6 in Breast Cancer. EBioMedicine. 2017; 21: 65–78. 5 Such E, Cervera J, Valencia A, Barragán E, Ibañez M, Luna I, et al. A novel NUP98/RARG gene fusion in acute myeloid leukemia resembling acute promyelocytic leukemia. Blood 2011;117: 242–245. 6 Ha JS, Do YR, Ki CS, Lee C, Kim DH, Lee W, et al. Identification of a novel PML-RARG fusion in acute promyelocytic leukemia. Leukemia 2017; 31: 1992–1995. 7 Marinelli A, Bossi D, Pelicci PG, Minucci S. A redundant oncogenic potential of the retinoic receptor (RAR) a, b and c isoforms in acute promyelocytic leukemia. Leukemia 2007; 21: 647–650. 8 Marinelli A, Bossi D, Pelicci PG, Minucci S. Redundant function of retinoic acid receptor isoforms in leukemogenesis unravels a prominent function of genome topology and architecture in the selection of mutagenic events in cancer. Leukemia 2009; 23: 417–419. © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. Figure legend Figure 1. Morphology and karyotyping analysis. (a) Several promyelocytes, with hypergranulated cytoplasm and invaginated nuclei, are shown. (Wright-Giemsa stained bone marrow smear, × 1000). (b) The peroxidase stain showed strong positivity. (c) G-banded karyotype showing 47,XY. Figure 2. Molecular analysis of the CPSF6-RARG fusion. (a) Sequencing chromatogram of the junction sequences of the major (exon 4 of CPSF6 and exon 2 of RARG genes) and minor (deletion of an additional 3-bp at 5’ end of RARG exon 2) fusion transcripts. (b) Schematic comparison between the major and minor CPSF6-RARG fusion transcripts. (c) Expected protein sequences translated from the major and minor fusion transcripts. The fusion was in-frame, and the RARG amino acid sequences were intact. The amino acids originating from the 5’-UTR are shown. (d) Western blotting assay showed the two bands (58 and 84 kD) individually corresponding to wild type and CPSF6-fused RARG protein.1: the patient with CPSF6-RARG; 2 and 4: two APL patients with PML-RARA; 3: NB4 cell line with PML-RARA. © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved. © 2018 Macmillan Publishers Limited, part of Springer Nature. All rights reserved.
