UNIVERSIDADE FEDERAL DE GOIAS
Sodré Neto
1. Quais as principais características da imunidade INATA?
Não requer exposição prévia ao antígeno,
Presente desde o nascimento
Não muda de intensidade com a exposição
Direcionada contra estruturas compartilhadas por grupos de microrganismos (não é específica para um único Ag)
A resposta é imediata
Não induz memória imunológica (em geral).
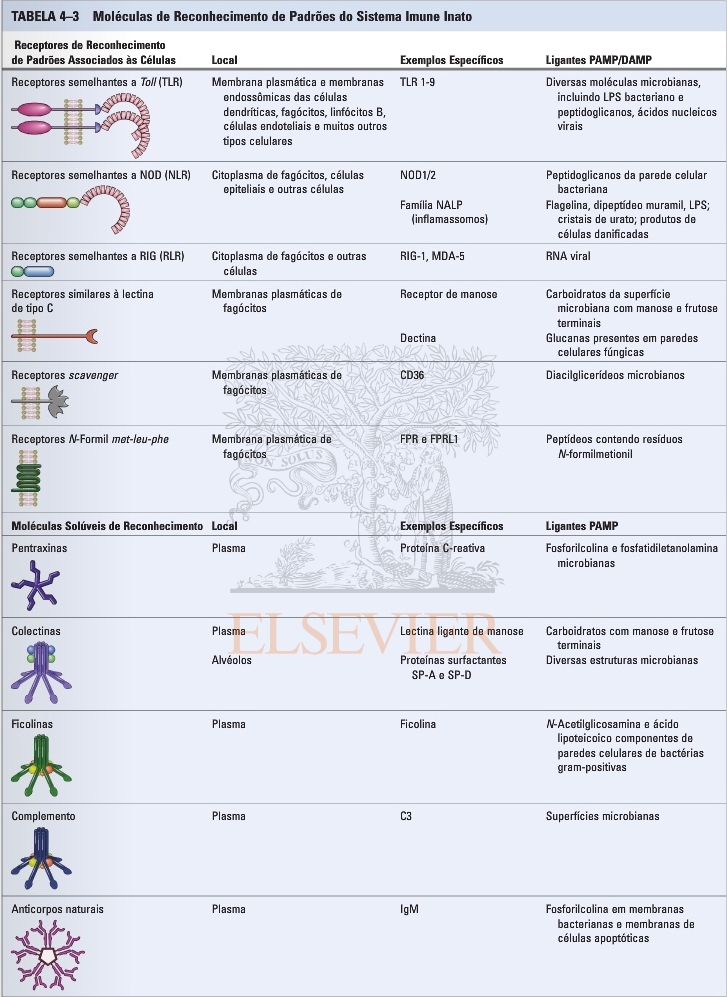
2. Quais os principais tipos de receptores de reconhecimento de patógenos (PPRs) e dê exemplos de receptores e seus ligantes
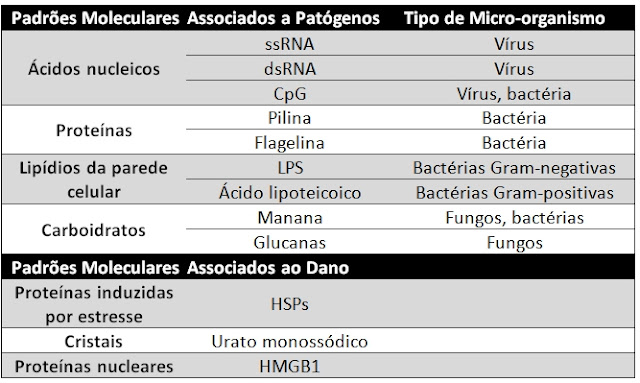
3. O que são PAMPs e DAMPS e dê exemplos
No próximo post iremos estudar sobre esses receptores (PRRs) e os mecanismos desecadeados após sua ativação.
4. Cite 4 tipos de barreiras naturais da imunidade inata.
- pele: possui fortes junções entre as células que evitam a entrada de microrganismos. A presença de ácidos graxos presentes no sebo e substâncias microbicidas no suor (como a lisozima) impedem a sobrevivência de muitos microrganismos.
- superfície das mucosas: o muco secretado por células locais é importante no aprisionamento de microrganismos, além de possuir substâncias microbicidas. Cílios presentes em células da traquéia auxiliam na movimentação do muco, impedindo a adesão de agentes estranhos ao organismo. O baixo pH estomacal e a presença de enzimas antimicrobianas na saliva também são importantes fatores de defesa.
- microbiológicas: constituída pela microbiota normal presente no intestino, que compete por espaço e nutrientes com microrganismos patogênicos, além de produzir substâncias antibacterianas.
O organismo têm barreiras básicas e simples, comuns, que estão em atividade contínua contra qualquer antígeno (agente agressor). A importância das barreiras naturais no combate às infecções é bem reconhecida. A integridade da pele e das mucosas impede a aderência e a penetração de bactérias; o movimento mucociliar (cílios da traqueia, pro ex.) elimina bactérias do trato respiratório; o pH ácido do estômago destrói bactérias que penetram pelo trato digestivo alto; e na saliva e secreções prostáticas existem substâncias com atividade antimicrobiana.
Tipos de Imunidade
O organismo conta com diferentes formas de mecanismos de defesa e estes são agrupados em imunidade inata e imunidade adquirida.
Imunidade Inata
Fazem parte da imunidade inata do organismo: Barreiras naturais físicas e químicas, células fagocíticas, sistema complemento, citocinas.
A participação da imunidade inata ocorre primeiramente pelas defesas naturais de barreiras físicas e químicas (pele, mucosas, pH do estômago, etc), que vencidas pelo agressor, passa a atuar através das células fagocitárias, da ativação do sistema complemento e da produção de quimiocinas e citocinas.
As proteínas circulantes do sistema complemento que se ligam na superfície do Antígeno (Ag) – agente agressor, ou se liga no Ag já neutralizado pelo Ac (anticorpo), de qualquer forma ou o sistema complemento lisa (quebra a estrutura e destrói) o Ag ou “facilita a fagocitose” atraindo os macrófagos que vão eliminar o sistema complemento em especial ligado ao complexo Ag-Ac.
Paralelamente atuam as células fagocitárias e as células do tecido agredido ou estimuladas pela presença do agressor começam a liberar uma série de substancias químicas que atraem mais células de defesa e ativam outros mecanismos, até mesmo a produção de anticorpos.
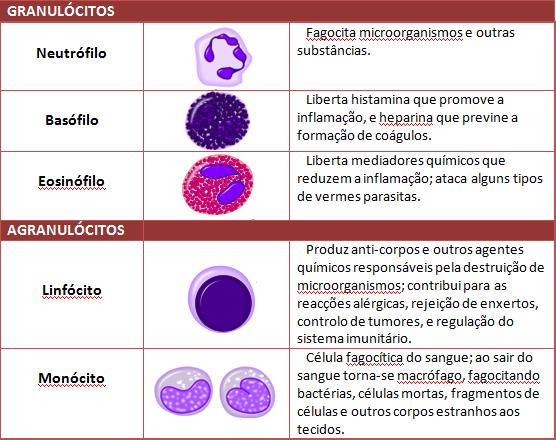
Todas as células da imunidade inata participam da defesa embora seja enfatizado principalmente o papel de neutrófilos e monócitos/macrófagos pela capacidade fagocítica dessas células.
Os basófilos e mastócitos ativados por fatores do sistema complemento, atraem leucócitos para o sítio de agressão e contribuem para a passagem dessas células dos vasos para os tecidos, local onde está ocorrendo a agressão ao hospedeiro. Os eosinófilos, além da atividade fagocítica, podem destruir microrganismos por meio da liberação de proteínas com atividade microbicida, tais como a proteína básica principal e a proteína catiônica eosinofílica.
Embora tanto os neutrófilos como os macrófagos sejam células fagocíticas, essas células possuem características bem diferentes. Os neutrófilos têm vida curta tanto no sangue como nos tecidos, só são encontrados nos tecidos inflamados e defendem principalmente contra as bactérias extracelulares. Já os macrófagos têm sobrevida prolongada, concentram-se tanto em tecidos inflamados como em tecido sadio, são fundamentais para a eliminação dos agentes intracelulares.
As células da resposta imune são também as principais fontes de citocinas e quimiocinas, as quais exercem sua ação tanto na fase inata como na adaptativa. As quimiocinas, devido a seu papel de atrair células para o sítio da lesão, são muito importantes no processo de defesa do hospedeiro. Existem vários tipos de quimiocinas e citocinas, as mais conhecidas são as Interleucinas (IL) e os Interferons (IF).Imunidade Adquirida (Adaptativa)
A imunidade adaptativa (adquirida), principalmente mediada por anticorpos, desempenha importante papel na defesa.
Os anticorpos podem exercer suas ações de três maneiras: opsonização (Ac se ligam aos Ag e atraem os macrófagos para a fagocitose desse complexo Ag-Ac), ativando o sistema complemento (as proteínas do complemento se ligam e destroem o Ag diretamente, ou destroem o complexo Ag-Ac já formado) e promovendo a neutralização de bactérias/Ags ou de seus produtos (Ac se ligam nos Ag e impedem suas ações no organismo).
A formação dos anticorpos se dá na chamada imunidade adaptativa (adquirida), com a invasão do Ag (agente agressor) e estímulo de células fagocitárias, em especial o macrófago, ainda na fase da imunidade inata, desencadeiam estímulos também de outras células com as células B e T helper.
Esta sequência dá origem a modificações celulares que culminam com a produção dos anticorpos pelas células B estimuladas e modificadas (que passam a chamar-se plasmócitos). Os plasmócitos (células B estimuladas e diferenciadas em resposta ao Ag) secretam pequenas moléculas específicas contra o agente agressor = anticorpos. Esta resposta, que leva a produção dos Ac é chamada de resposta humoral.
As células B estimuladas (sensibilizadas) que não se diferenciam em plasmócitos, ficam “na reserva” e podem ser rapidamente estimuladas em uma nova infecção e produzirem Ac rapidamente. Estas células B sensibilizadas e não diferenciadas são chamadas de células B de memória.
Paralelamente, outras células T podem ser estimuladas e passam a atuar, como as células Killer e NK (natural killer), em especial no caso de infecções virais. Esta resposta é denominada de resposta celular.
A resposta mediada pelas células T é extremamente efetiva no mecanismo de defesa contra agentes intracelulares, como vírus, protozoários, fungos e bactérias intracelulares. As células T podem exercer sua função através da citotoxicidade mediada por células CD8+ ou através da secreção de citocinas que vão ativar macrófagos para destruir os agentes intracelulares.
Se de um lado já eram conhecidas as células e os mediadores envolvidos nas defesas dos humanos, só recentemente foi documentado o fato de que a população de células TCD4+ (T helper) é heterogênea, sendo constituída de duas subpopulações: as células Th1 e Th2. Essa observação tem contribuído bastante para o entendimento da imunopatogênese da maioria das doenças infecciosas.
É fundamental o entendimento de que tanto a resposta Th1 como a resposta Th2 são importantes na defesa do hospedeiro contra as infecções. A resposta Th1 está relacionada com a defesa contra protozoários, bactérias intracelulares e vírus, enquanto a resposta Th2 é mais efetiva contra os helmintos e bactérias extracelulares
.
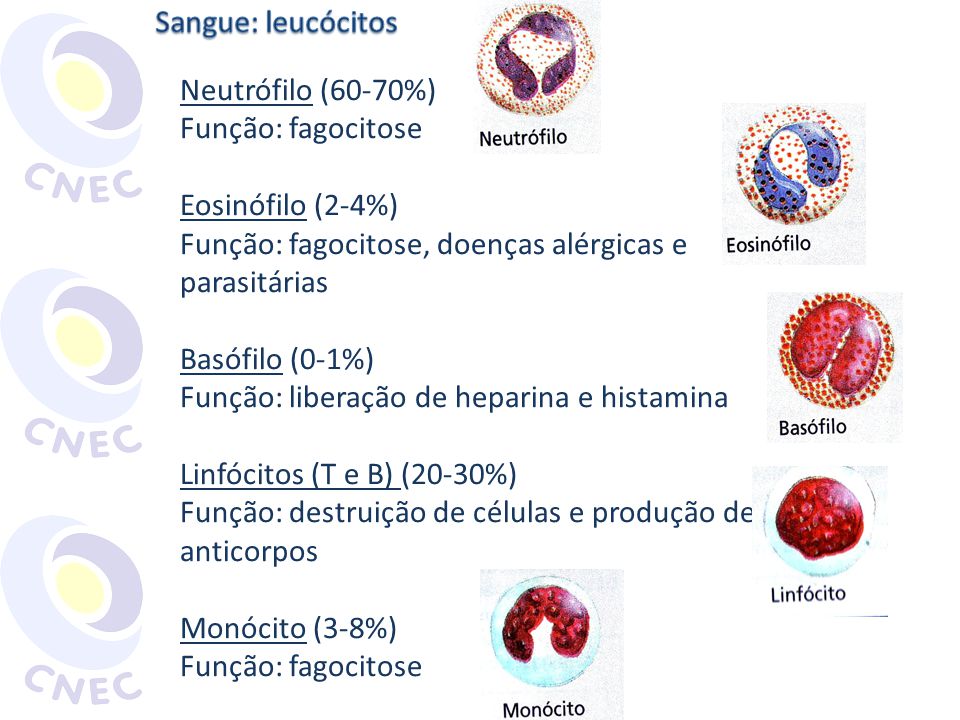
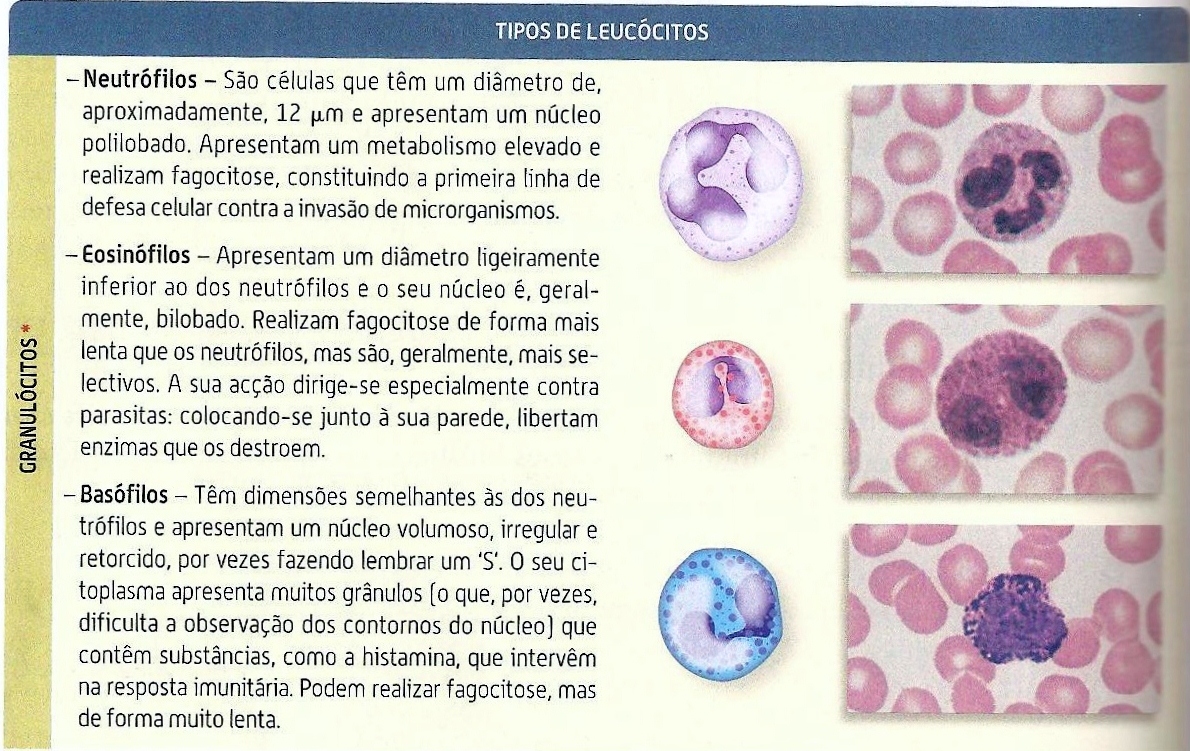
5. Quais . principais funções dos seguintes tipos celulares:
a. - Macrófago
b - Neutrófilo
c. - Mastócito, Basófilo, Eosinófilo
d. - Célula dendrítica
e - Célula NK
6. Qual a principal célula e quais as principais citocinas envolvidas na imunidade anti-viral?




7. Como funciona a atividade microbicida dos macrófagos?
8. Descreva o processo de inflamação.
consiste no recrutamento celular com a finalidade de amplificar a resposta imunológica no sítio infeccioso. Quando macrófagos residentes são ativados ao reconhecerem o agente infeccioso por PRR, produzem citocinas pró-inflamatórias (IL-1, TNF e IL-6) que estimulam as células do endotélio vascular a expressarem moléculas de adesão (selectinas). As selectinas são reconhecidas por receptores expressos nos leucócitos circulantes, o que promove a fraca adesão destas células à superfície endotelial. Devido à força do fluxo sanguíneo em conjunto com a fraca adesão, os leucócitos circulantes deslizam sobre o endotélio (rolamento). Quimiocinas produzidas no local da infecção pelas células residentes e por células endoteliais ativadas auxiliam no recrutamento e na adesão dos leucócitos ao endotélio, além de induzirem aumento da afinidade de ligação das integrinas (outra classe de moléculas de adesão) expressas nos leucócitos aos seus ligantes nas células endoteliais. Tal interação intensifica mais a adesão destas células ao endotélio e inicia o processo de migração, no qual os leucócitos transpassam a parede endotelial por diapedese, alcançando o sítio de infecção nos tecidos a fim de eliminar os microrganismos.
Além do recrutamento celular, as células residentes no local infeccioso (fagócitos, mastócitos) também produzem mediadores que aumentam o fluxo sanguíneo (rubor e calor), causam a vasodilatação e o aumento da permeabilidade do endotélio vascular. Consequentemente, há o acúmulo de fluídos e células provenientes da circulação, formando o edema (inchaço). Tais alterações teciduais causadas por estes mediadores inflamatórios sensibilizam receptores neuronais levando à dor e, em casos mais crônicos, à perda de função do local inflamado. Deste modo, calor, rubor, inchaço, dor e perda de função, são os sinais clínicos da inflamação.
Além de ser crucial no recrutamento e na amplificação dos mecanismos efetores da imunidade inata, a inflamação também é importante em outras funções, como remoção de células e tecidos lesados, inativação de toxinas e reparo tecidual.
Figura 1. Ilustração da ativação e indução dos mecanismos efetores da imunidade inata contra microrganismos. Devido ao rompimento das barreiras epiteliais, os microrganismos alcançam os tecidos subjacentes. Fagócitos residentes reconhecem PAMP de microrganismos através dos seus receptores PRR e fagocitam os agentes infecciosos, que são englobados dentro de fagossomos que por fim se fundem a lisossomos (fagolisossomos). Dentro dos fagolisossomos, os microrganimos são destruídos pela ação das enzimas líticas lisossomais e das espécies reativas de oxigênio (ROS) e nitrogênio (óxido nítrico - NO) (Fagocitose). Os fagócitos ativados produzem mediadores inflamatórios que induzem a expressão de moléculas de adesão e receptores na superfície endotelial (selectinas e receptores para integrinas) que facilitam a adesão dos leucócitos circulantes (neutrófilos, inicialmente). Em resposta a quimiocinas produzidas no local, os leucócitos migram para o sítio de infecção nos tecidos por diapedese (Inflamação), onde reconhecem os microrganismos e exercem suas funções na tentativa de eliminá-los.
3. Implicações clínicas na imunidade inata
A importância da imunidade inata é constatada quando se observa o que certas alterações em seu funcionamento podem acarretar na defesa do organismo. Deficiências em seus componentes, evasão de seus mecanismos efetores por microrganismos e polimorfismos genéticos em seus receptores podem causar efeitos deletérios na imunidade do organismo. Por exemplo, indivíduo com baixo número de neutrófilos (neutropênico) é mais susceptível a infecções fúngicas e bacterianas do que indivíduo que apresente número normal destas células. Microrganismos que conseguem sobreviver no interior de fagócitos estabeleceram alguns mecanismos de evasão à fagocitose, como a lise da membrana do fagossomo, o impedimento da fusão deste com lisossomos e a alteração do pH do fagolisossomo, que inibe a atividade de enzimas microbicidas. Por outro lado, há doenças congênitas nas quais o indivíduo apresenta deficiências na funcionalidade da resposta imune inata (Tabela).
Disfunções na amplitude da atividade de seus mecanismos efetores também levam efeitos negativos ao organismo. O choque séptico é um exemplo do que ocorre quando a resposta inflamatória é exagerada. Isso ocorre em consequência da alta produção de mediadores inflamatórios na corrente sanguínea pelas células que são ativadas ao reconhecerem microrganismos que se multiplicam no sangue. Como resultado, o excesso de mediadores produzidos leva à vasodilatação sistêmica o que diminui a pressão arterial, resultando em irrigação sanguínea insuficiente nos órgãos (choque).
|
DOENÇA |
DEFICIÊNCIA |
CONSEQUÊNCIA |
|
Granulomatose crônica |
Produção deficiente de ROS por fagócitos. |
Infecções recorrentes com bactérias intracelulares e fungos. |
|
Deficiência de adesão leucocitária tipo-1 |
Expressão reduzida ou ausência de integrinas. |
Infecções recorrentes de bactérias e fungos. |
|
Deficiência de adesão leucocitária tipo-2 |
Expressão reduzida ou ausência de selectinas. |
Infecções recorrentes de bactérias e fungos. |
|
Síndrome de Chédiak-Higashi |
Formação de fagolisossomos. |
Infecções recorrentes com bactérias piogênicas. |
|
Defeitos Toll-like |
Sinalização TLR |
Infecções microbianas recorrentes. |
Tabela: Doenças congênitas relacionadas à imunidade inata.
9. Diferencie a Via clássica. alternativa e via das lectinas na ativação do complemento
Via clássica
Nessa via a montagem e a organização das convertases são habitualmente iniciadas por anticorpos da classe IgG ou IgM formando complexos com o antígeno. Várias outras substâncias, tais como os complexos da proteína C-reativa (PCR), determinados vírus e bactérias Gram-negativas, também podem ativar esta via. Os ativadores são reconhecidos por C1q, uma das três proteínas do complexo C1. Esta ligação ativa C1r que ativa a pró-enzima C1s. Então, C1s ativado cliva C4, resultando na fixação covalente do seu principal fragmento, C4b, à superfície do ativador. O componente C2 liga-se a C4b e é clivado por C1 em dois fragmentos (este processo necessita da intervenção de Ca2+ o Mg2+), dos quais C2a permanece ligado a C4b, completando a montagem do complexo C4b2a, que é a C3 convertase da via clássica. Esta cliva C3 resultando na ligação de C3b à superfície do ativador e na ligação posterior de C3b à subunidade C4b2a, formando a C4b2a3b que é C5 convertase da via clássica..P
Via da Lectina
A via da lectina utiliza uma proteína similar a C1q para ativar a cascata do complemento, a lectina ligadora de manose (MBL). A MBL liga-se a resíduos de manose e outros açúcares, organizados em um padrão, que recobrem superficialmente muitos patógenos. A lectina ligadora de manose é uma molécula formada por duas a seis cabeças, semelhante a C1q, que formam um complexo com duas serina proteases a MASP-1 e MASP-2. MASP-2 é similar as proteínas C1r e C1s. Quando o complexo MBL liga-se à superfície de um patógeno, MASP-2 é ativada para clivar C4, em C4a e C4b, e C2 em C2a e C2b, originando a C3 convertase da via da lectina - C4b2b. O papel de MASP-1 ainda não está bem claro na ativação do complemento.
As pessoas deficientes em MBL têm maior suscetibilidade a infecções na infância, o que mostra a importância da via da lectina na defesa do hospedeiro.
Via Alternativa
Esta via foi denominada alterna por razões históricas, por ter sido descoberta após a via clássica. A ativação desta via inicia-se a partir da hidrólise espontânea tiol-éster localizada na cadeia alfa do componente C3, gerando o C3(H20).Esta molécula exibe sítios reativos que permite a ligação de uma proteína plasmática, fator B (fB), formando o complexo C3(H2O)B. O fB então é clivado por uma enzima denominada fator D (fD). Esta clivagem origina 2 fragmentos Ba e Bb. O fragmento Bb fica ligado a C3(H2O), gerando o C3(H2O)Bb, que na presença de íons Mg++, tem atividade serino-protease, clivando o C3 em C3a e C3b. Assim como o C3(H2O), C3b também apresenta sítio de ligação com o fB. Formando o complexo C3bBb, após clivagem do fB em fBb e fBa pelo fD. O C3bBb atua então como C3 convertase, clivando mais moléculas de C3, formando C3bBb3b que cliva C5 em C5a e C5b. O fragmento C5b permanece ligado ao complexo e os outros componentes (C6,C7, C8 e C9)se ligam para a formação MAC
Complexo de Ataque à Membrana (MAC)
A clivagem de C5 pela C5-convertase produz C5a, que é lançado nas vizinhanças do plasma onde é uma potente anafilatoxina (como C3a) e uma agente quimiotático para neutrófilos; C5b, que serve como uma âncora para a formação de uma única estrutura composta por C6, C7 e C8.
O complexo resultante C5b-6-7-8 guia a polimerização de até 18 moléculas de C9 em um tubo inserido na bicamada lipídica da membrana plasmática. Esse tubo forma um canal permitindo a passagem de íons e pequenas moléculas. Água entra na célula por osmose e a célula sofre lise.
10N . Como funciona a atividade microbicida dos macrófagos
VII. Função dos macrófagos 1. Fagocitose A fagocitose é um dos principais mecanismos de suporte da imunidade inata e é um processo onde células mortas e partículas estranhas são captados e posteriormente ingeridos por células fagocíticas, sendo também um processo importante para a eliminação de células tumorais (Pacheco, 2012). Apenas os fagócitos profissionais são funcionalmente dotados de capacidades fagocíticas importantes. A ligação aos recetores SR, MR e TLR, bem como a ligação de partículas opsonizadas a recetores de complemento e do fragmento Fc, estimulam a fagocitose. No entanto, este processo é regulado negativamente por outros recetores, tais como os recetores para a cisteína, bem como por alguns patogénos que inibem este mecanismo dos macrófagos (Takeda e Akira, 2005; Ezekowitz e Gordon, 2006). Durante a fagocitose é desencadeada a degradação do patogéno e posterior apresentação dos seus antigénios, associados ao MHC, conduzindo ao desenvolvimento da imunidade adquirida (Teo, 2003; Strauss, 2010). A fagocitose é um processo que ocorre seguindo uma serie de etapas. Esta é iniciada, por um processo não dependente de energia, quando se dá a ligação de uma determinada partícula à membrada da célula fagocítica. Após esta ligação pode-se dar ou não a transmissão de um sinal que leva (ou não) a posterior ingestão da partícula que se adere Macrófagos: Biologia, Diversidade e Função 18 ao fagócito. Os antigénios microbianos são reconhecidos por PRR, como os TLR, e uma ampla gama de recetores não-opsónicos. Quando se dá a ingestão resultante da interação entre recetores da e a superfície da partícula, ocorre a emissão de pseudópodes (extensões provenientes do citoplasma, constituídos por filamentos de actina e miosina) que envolvem a partícula, resultando na fusão que origina um vacúolo fagocítico, no interior da célula. O vacúolo fagocítico (fagossoma) passa por um processo de maturação até, num estadío final, fundir com lisossomas, onde as enzimas hidrolíticas, ROS e RNI contribuem para a degradação microbiana (Appelberg, 2005; Pacheco e Cardoso, 2012). A fagocitose leva a ativação dos macrófagos e à indução da libertação de uma serie de moléculas onde se incluem as citocinas pró-inflamatórias, tais como IL-1, IL-6 e TNF, bem como outras toxinas mediadoras que promovem o dano nos tecidos, se produzidas em excesso. Normalmente, a resposta inflamatória é seguida por uma resposta antiinflamatória, conduzindo a um equilíbrio (Pacheco e Cardoso, 2012). Durante a fagocitose ocorre a estimulação de uma série de processos bioquímicos e metabólicos, onde se inclui o aumento da utilização da glucose e do consumo de oxigênio (Schindl et al., 2006). 2. Apoptose A apoptose é um processo natural, que pode tomar a designação de morte celular programada e que se desenrola durante o desenvolvimento, promovendo a remodelação tecidular e o desenvolvimento da homeostase. De facto, a apoptose é essencial para a regulação do número de células no hospedeiro, de modo a haver um equilibrio entre o número de células eliminadas e as que sofrem divisão celular. É também importante para o a função do sistema imunitário e, particularmente no desenvolvimento embrionário (Elmore, 2007). O processo da apoptose recorre a uma serie de mecanismos bioquímicos e alterações morfológicas (Albert et al., 2002; Elmore, 2007). Depende de uma família de proteases, as quais apresentam um grupo cisteína no seu local ativo. Estas proteínas são proteases que clivam outras proteínas nos locais que contêm resíduos de ácido aspártico e tomam a designação de caspases. A ação das caspases na degradação de porções especificas da célula, num processo contínuo, envolvendo a ativação em cascata de diversas caspases (Albert et al., 2002). Com o avançar do processo a célula vai tomando Macrófagos: Biologia, Diversidade e Função 19 dimensões mais reduzidas, ocorre fragmentação nuclear, o citoplasma fica mais denso e os organelos ficam mais agrupados, levando a formação de corpos apoptóticos, após formação e libertação de "bolhas" a partir da membrana das células (Elmore, 2007). Apos a morte celular por apoptose, a célula ou seus corpos apoptóticos é rapidamente fagocitada e eliminada por macrófagos (Savill et al., 2002). Embora seja comum afirmar que este é um processo neutral sob o ponto de vista imunológico, existem evidências que contrariam essa afirmação. De facto, a fagocitose das células apoptóticas pode levar à produção de mediadores anti-inflamatórios e a imunossupressão (situações de deficiente eliminação de células apoptóticas, podem conduzir a doenças autoimunes e inflamatórias). Por outro lado, noutras situações a remoção de células apoptóticas pode levar a exacerbação da inflamação (Savill et al., 2002; Teo, 2003). Se a taxa de apoptose exceder a capacidade de remoção pelos macrófagos, as células apoptóticas podem tornar-se necróticas, resultando na libertação do conteúdo celular, levando ao dano no tecido envolvente, sendo a depuração um passo essencial para a resolução deste processo (Teo, 2003). Figura 9- A Importância da remoção de neutrófilos (figura adaptada de (Teo, 2003)) Esta figura demonstra a importância da remoção de neutrófilos apoptóticos pelos macrófagos, pois se os neutrófilos entram em necrose derramam o conteúdo dos seus grânulos e causam uma inflamação extensa. Os macrófagos ao fagocitarem os neutrófilos impedem essa inflamação e ainda aumentam o seu arsenal microbicida, recebendo o conteúdo granular dos neutrófilos (TEO,2003). Este precesso (cooperação Macrófagos: Biologia, Diversidade e Função 20 neutrófilo-macrófago) desempenha um importante papel nos mecanismos de defesa contra infeções (Appelberg, 2005; Pacheco e Cardoso, 2012). https://bdigital.ufp.pt/bitstream/10284/5175/1/PPG_23493.pdf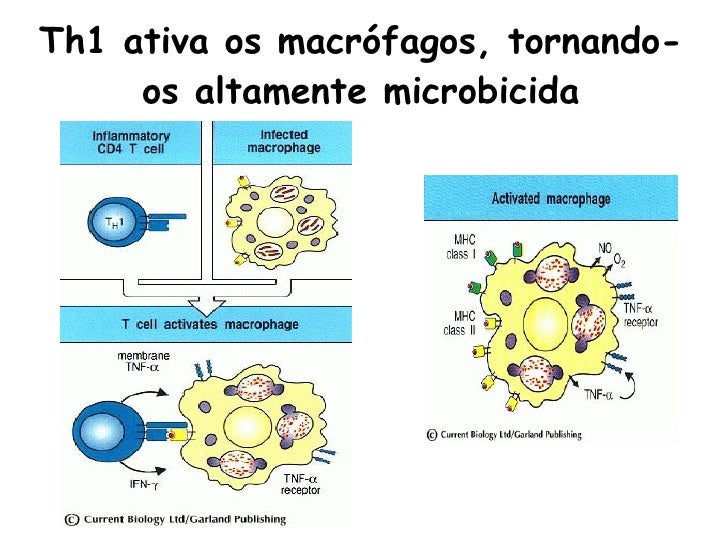

8. Descreva o processo de inflamação. Diferencie a Via clássica, alternativa e via das Lectinas na ativação do complemento
Tabela 1. Proteínas do sistema Complemento
Via Lítica
Proteínas de ativação:
C1qrs, C2, C3, C4
Proteínas de Controle:
C1-INH, C4-BP
Proteína de ligação à manana (MBP), protease manana-associada a serina (MASP, MASP2)C3, Fatores B & D*, Properdina (P)
Fatores I* & H, fator acelerador de decaimento (DAF), Receptor de complemento 1(CR1), etc.
C5, C6, C7, C8, C9
Proteína S
Componentes sublinhados adquirem atividade enzimática quando ativados.
Componentes marcados com um asterisco têm atividade enzimática na sua forma inativa.
|
VIAS DE ATIVAÇÃO DO COMPLEMENTO |
|||||||||||||||||||||||||||||||||
|
FILME |
|||||||||||||||||||||||||||||||||
|
VIA CLÁSSICA (Figura 2) Ativação de C1 Ativação de C4 e C2 (geração de C3 convertase) Ativação de C3 (geração de C5 convertase) Alguns dos produtos da via clássica têm atividades biológicas potentes que contribuem para as defesas do hospedeiro. Alguns desses produtos também têm efeitos detrimentais se produzidos de maneira não regulada. Tabela 2 sumariza as atividades biológicas dos componentes da via clássica.
A importância de C1-INH na regulação da via clássica é demonstrada pelo resultado de uma deficiência neste inibidor. Deficiências de C1-INH estão associadas com o desenvolvimento de angioedema hereditário.
|
|||||||||||||||||||||||||||||||||
| A. Geração da C3 convertase na via clássica
B Geração da C5 convertase na via clássica C Figura 2
|
|||||||||||||||||||||||||||||||||
| Figura 3 Via iniciada pela lectina |
VIA DA LECTINA
|
||||||||||||||||||||||||||||||||
| Figura 4 Ativação espontânea de C3 |
VIA ALTERNATIVA No soro há um baixo nível de hidrólise espontânea de C3 para produzir C3i. O fator B liga-se a C3i e se torna susceptível ao Fator D, que cliva o Fator B em Bb. O complexo C3iBb age como uma C3 convertase e cliva C3 em C3a e C3b. Uma vez formado C3b, o Fator B ligar-se-á a ele e tornar-se-á susceptível à clivagem pelo Fator D. O complexo C3bBb resultante é uma C3 convertase que continuará a gerar mais C3b, amplificando assim a produção de C3b. Se este processo continuar sem parar, o resultado seria o consumo de todo o C3 do soro. Dessa forma, a produção espontânea de C3b está estreitamente controlada. |
||||||||||||||||||||||||||||||||
|
Figura 5
Figura 6 Regulação de C3 ativada pelo Cr1
Figura 7 Estabilização da C3 convertase Figura 8 |
Controle do circuito de amplificação (Figuras 5 e 6) |
||||||||||||||||||||||||||||||||
| Lembrem-se de que a via alternativa proporciona um meio de resistência não específica contra infecção sem a participação de anticorpos e, portanto fornece a primeira linha de defesa contra uma variedade de agentes infecciosos.
Muitas bactérias gram negativas e algumas gram positivas, certos vírus, parasitas, células vermelhas heterólogas, agregados de imunoglobulinas (particularmente IgA) e algumas outras proteínas (ex. proteases, produtos da via de coagulação) pode ativar a via alternativa. Uma proteína, o fator do veneno da cobra (CVF), tem sido extensivamente estudada pela sua habilidade de ativar esta via.
|
|||||||||||||||||||||||||||||||||
| Figura 9 Via lítica |
VIA DO ATAQUE À MEMBRANA (LÍTICA) (figura 9) A C5 convertase das vias clássica (C4b2a3b), da lectina (C4b2a3b) ou alternativa (C3bBb3b) cliva C5 em C5a e C5b. C5a permanece na fase fluida e C5b se associa rapidamente com C6 e C7 e se insere na membrana. Subsequentemente C8 liga-se, seguido por algumas moléculas a C9. As moléculas C9 formam um poro na membrana através do qual os conteúdos celulares vazam e ocorre a lise. A lise não é um processo enzimático; acredita-se que seja devido ao dano físico à membrana. O complexo consistindo em C5bC6C7C8C9 é referido como complexo de ataque à membrana (MAC).C5a gerado na via lítica tem várias e potentes atividades biológicas. É a mais potenteanafilotoxina. Além disso, é um fator quimiotáctico para neutrófilos e estimula a queima respiratória neles e estimula a produção de citocina inflamatória pelos macrófagos. Sua atividade é controlada pela inativação pela carboxipeptidase B (C3-INA). Alguns dos complexos C5b67 formados podem se dissociar da membrana e entrar na fase fluida. Se for isso o que acontece então ele pode se ligar a outras células vizinhas e provocar sua lise. A lesão a células das vizinhanças é impedida pela Proteína S (vitronectina). Proteína S liga-se ao C5b67 solúvel e impede sua ligação a outras células.
|
||||||||||||||||||||||||||||||||
http://www.microbiologybook.org/Portuguese/immuno-port-chapter2.htm